别样的免疫治疗,打开胃癌治疗的神奇大门——潘宏铭教授
整理:肿瘤资讯
来源:肿瘤资讯
胃癌是我国第二大癌症,我国胃癌患者发病时多为局部晚期或晚期,预后较差。化疗和靶向作为晚期胃癌的主要治疗手段,但疗效有限。不同于传统治疗,免疫检查点抑制剂通过恢复T细胞的杀伤反应、促进T细胞活化增殖、抑制T细胞衰竭,实现抗肿瘤治疗。目前,以纳武利尤单抗为代表的PD-1抑制剂已经在日本、韩国、新加坡、中国台湾等地区获批用于胃癌治疗;多项免疫治疗相关研究正在开展,有望为胃癌这类难治性肿瘤带来新希望。【肿瘤资讯】特邀浙江大学医学院附属邵逸夫医院的潘宏铭教授为我们深入分析了肿瘤免疫治疗的作用机制以及其在胃癌中的应用。

潘宏铭教授
浙江大学医学院附属邵逸夫医院 副院长
教授、博导、博士后导师
肿瘤内科主任,主任医师
国家新药审评专家
卫生部合理用药专家委员会委员
卫生部胃癌诊治规范制定专家
中国抗癌协会肿瘤靶向治疗专业委员会副主任委员
中国临床肿瘤学会(CSCO)常务理事
中国肿瘤营养治疗专家委员会主任委员
浙江省肿瘤防治联盟主席
浙江省抗癌协会肿瘤内科专业委员会主任委员
浙江省肿瘤靶向治疗技术指导中心主任
胃癌治疗面临的挑战
根据2017年世界癌症研究机构(IARC)最新发布的《五大洲癌症发病率》数据显示,胃癌是我国的第二大癌症,全世界近一半新发胃癌患者和死亡病例在中国。国家卫健委刚刚发布的《2018版胃癌诊疗规范》指出,我国早期胃癌占比很低,仅约20%,大多数发现时已是局部晚期或晚期,错失了最佳诊治时机,预后较差。
化疗和靶向治疗是局部进展期或晚期胃癌的主要治疗手段。目前,在胃癌靶向治疗的III期临床研究中,仅有2类药物中的4个研究取得阳性结果,分别为ToGA、REGARD、RAINBOW和阿帕替尼的研究。化疗仍然是晚期胃癌目前最主要的治疗手段,但单纯使用化疗的疗效有限。总体而言,靶向治疗和单纯化疗在晚期胃癌治疗中的疗效存在瓶颈。
近年来,免疫治疗作为抗肿瘤治疗的新星,在多个瘤种中显示出卓越疗效。免疫治疗在胃癌中也有多项研究,并取得初步的进展,有望为晚期胃癌治疗带来新希望。
肿瘤免疫治疗的作用机制
人体的免疫系统主要三大功能为免疫防御、免疫监视和免疫自身稳定,正常情况下,免疫系统能够发挥以上三大功能。然而,肿瘤细胞可以通过多重机制逃避免疫系统的杀伤。在肿瘤与免疫系统的对抗过程中,发生基因突变的肿瘤细胞能否形成肿瘤取决于肿瘤细胞与免疫系统之间相互作用的结果。癌症通过“免疫监视、免疫平衡和免疫逃逸”三个阶段实现肿瘤免疫编辑。在免疫监视阶段,有效递呈抗原以及T细胞活化,使得效应T细胞能够有效清除肿瘤抗原,肿瘤抗原启动免疫应答,从而抑制肿瘤发展。而在免疫监视阶段存活的肿瘤细胞,可以进入平衡期,细胞免疫原性由适应性免疫系统编辑,将肿瘤细胞的净增殖维持在稳态。如果肿瘤逃脱免疫系统的控制,即发生免疫逃逸,肿瘤细胞将进入无限增殖的阶段,出现生长、侵犯和转移。
肿瘤免疫治疗工作原理是基于肿瘤逃逸机制的研究成果。肿瘤细胞利用免疫检查点通路,以不同的方式关闭免疫应答,从而逃避免疫杀伤。其中,PD-1/PD-L1等免疫检查通路阻断是肿瘤逃逸的主要机制之一。其理论来源于T细胞的活化需要双信号:一个是来自于与MHC分子结合的抗原;一个是协同刺激信号。必须同时存在抗原信号和共刺激信号T细胞才能活化,实现抗肿瘤效应。此外,T细胞的活化幅度和质量取决于刺激信号和抑制信号之间的平衡。正常情况下,协同抑制信号(co-inhibitory signal)将正在进行的免疫反应控制在一定范围内,防止对机体健康组织的损伤。这些抑制性信号通路也被称为免疫检查点(immune checkpoints)。
综上,解除抑制方能治本。以水管被堵塞为例,最有效的措施是移除堵塞物疏通水管,而非强行加大水流(图1)。PD-1/PD-L1抑制剂,主要通过解除免疫抑制,促进T细胞活化增殖、恢复细胞毒性T细胞的杀伤功能,抑制T细胞衰竭,从而恢复T细胞的杀伤反应,实现抗肿瘤治疗。其在临床多个瘤种的应用也印证了这一理论的正确性。短短数年间,PD-1/PD-L1以及CTLA-4免疫检查点抑制剂的应用范围已大大超越既往的IL-2这一单纯的免疫系统刺激手段。

图1. PD-1/PD-L1抑制剂解除免疫抑制示意图[1]
免疫治疗药物在胃癌中的应用
目前,免疫治疗在局部晚期或转移性胃癌中进行了多项研究,其中PD-1单抗纳武利尤单抗的复发性局部晚期或转移性胃癌适应证已获日本、韩国、中国台湾、新加坡批准,帕博利珠单抗获FDA批准用于PD-L1阳性的复发性局部晚期或转移性胃癌/胃食管结合部腺癌。
纳武利尤单抗获批是基于一项在亚洲人群中进行的III期ATTRACTION-02研究。研究入组了不可切除的晚期或复发性胃或胃食管结合部癌,要求患者既往接受过≥2种标准治疗方案进展或不耐受。入组患者以2:1随机分配接受纳武利尤单抗或安慰剂治疗,主要终点为总生存期(OS)。中位随访24个月的结果显示,纳武利尤单抗对比安慰剂组显著延长OS,两组的中位OS分别为5.26个月 vs 4.14个月,显著降低患者的死亡风险达38%;24个月总生存率对比,纳武利尤单抗组也显著优于安慰剂组,分别为10.6%和3.2%(图2)。这是迄今胃癌三线治疗随访期最长的III期研究。此外,在一项欧美胃癌患者的CheckMate-032研究中,纳武利尤单抗单药治疗二线及以上治疗胃癌/胃食管结合部癌的客观应答率(ORR)达到12%,12个月的OS率为39%,且安全性可接受[2]。
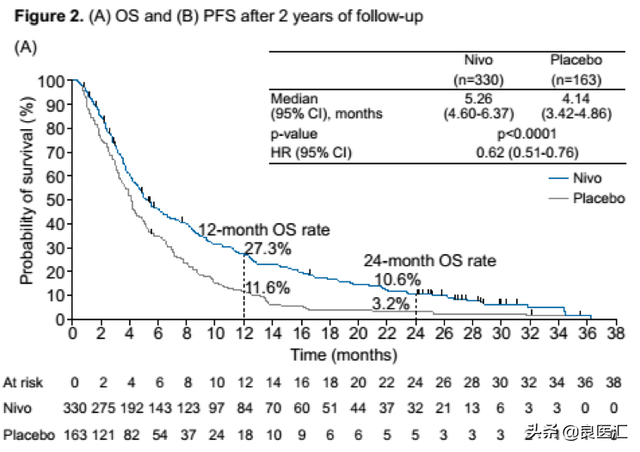
图2. ATTRACTION-02研究2年随访结果
帕博利珠单抗的获批是基于II期KEYNOTE-059研究中队列1的数据,该研究中帕博利珠单抗单药治疗PD-L1阳性胃癌的ORR为15.5%,基于此,FDA批准其用于PD-L1阳性且至少接受过二线以上化疗的复发性局部晚期或转移性胃癌/胃食管结合部腺癌患者。但在KEYNOTE-061中,帕博利珠单抗单药挑战化疗未能成功,其作为晚期胃癌/胃食管结合部癌二线治疗在PD-L1阳性的人群中未较紫杉醇显著改善PFS(1.5个月 vs 4.1个月,P=0.0421)和OS(9.1个月 vs 8.3个月,P=0.0421)[3]。免疫治疗在胃癌中的最佳治疗方式和最适合人群仍需探索。
综上,免疫检查点抑制剂单药治疗的反应率仍然不高。因此,需要探索联合治疗的方法来改善预后,在CheckMate-032研究中纳武利尤单抗(1 mg/kg) 联合伊匹木单抗(3 mg/kg)ORR为24%。纳武利尤单抗在联合化疗方面也进行了积极探索,ATTRACTION-4 研究评估了纳武利尤单抗在胃癌一线治疗联合SOX与CapeOX方案的有效性与安全性,其中纳武利尤单抗联合SOX方案的ORR达到了67%,而联合CapeOX更达到了惊人的71%,而在KEYNOTE-59 研究队列2中帕博利珠单抗联合5-FU/顺铂用于进展期胃癌一线治疗也显示出可观的抗肿瘤活性,在所有患者中ORR为60%,这两个研究虽然入组的病例数较少,但也提示了联合化疗可能会提高疗效。 同时,CheckMate 649的全球三期研究也在进行中,评估纳武利尤单抗联合XELOX(卡培他滨+奥沙利铂)或FOLFOX(5-FU+奥沙利铂)方案在胃癌一线治疗的作用。该研究有中国患者参与,我们期待该研究为胃癌患者带来生存预后的革新。
总结
晚期胃癌有效的治疗手段十分有限,且长久以来疗效难有突破,患者预后不容乐观,肿瘤免疫治疗因其独特的作用机制,或许能为这类人群带来生命的转机,期待这类别样武器,能打开胃癌治疗的神奇大门。
参考文献
1. SANMAMED M F, CHEN L P. A Paradigm Shift in Cancer Immunotherapy: From Enhancement to Normalization. [J]Cell, 2018 oct 4; 175(2): 313-326.
2.JANJIGIAN Y Y,BENDELL J,CALVO E,KIM J W,ASCIERTO P A, SHARMA P,et al. CheckMate-032 Study: Efficacy and Safety of Nivolumab and Nivolumab Plus Ipilimumab in Patients With Metastatic Esophagogastric Cancer.[J]J Clin Oncol 2018;36(28):2836-2844.
3.SHITARA K,OZGUROGLU M,BANG Y J,et al. Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial. [J]Lancet 2018;392(10142):123-133.
版权声明
版权归肿瘤资讯所有。欢迎个人转发分享,其他任何媒体、网站如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:良医汇-肿瘤医生APP”。




















评论