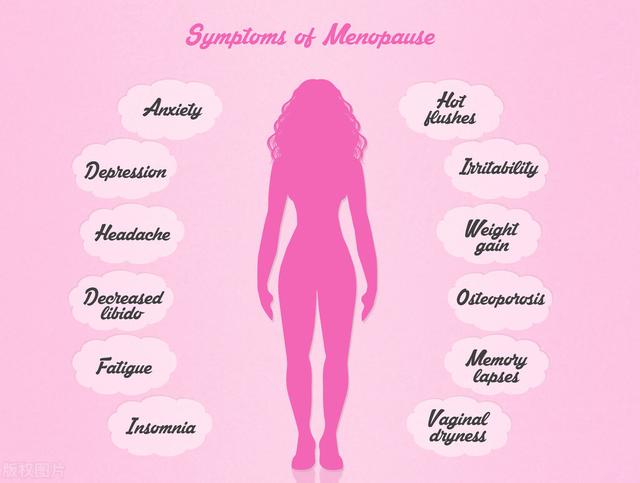
抗炎症饮食(三):抗性淀粉很难吃,但很健康
这一篇介绍饮食中的碳水化合物,在不改变淀粉占比的情况下,如何减少炎症和代谢性疾病风险。关键在于利用抗性淀粉取代精制淀粉食物。
下文先介绍几个概念,包括抗性淀粉、全谷类和升糖指数,接着从循证角度了解精制碳水和抗性淀粉分别对健康的影响,最后我们回到日常生活中,在食物的选择和处理上稍作改变,增加抗性淀粉在饮食的比例。
什么是抗性淀粉? 狭义的抗性淀粉指的是在小肠内完全不被吸收的淀粉,但我觉得广义的抗性淀粉可能更有应用价值,也就是从完全不被小肠吸收的到减慢在小肠吸收的淀粉,都可以理解为抗性淀粉,分别在于程度而已。抗性淀粉包括全谷类、薯类、杂豆类和某些没有完全成熟的水果,例如生的香蕉,生的苹果等.
什么是全谷物? 全谷物是指未经精细加工或碾压粉碎等处理,仍然保留了完整谷粒所具备的胚乳、胚芽、麸皮及其天然营养成分的谷物。全谷物包括例如小米、玉米、燕麦、全麦粉等。[1]
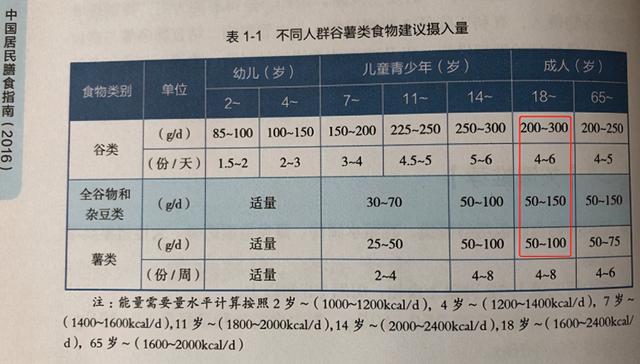
下图是中国营养学会对淀粉类碳水化合物组成的建议[1],每天谷薯类250g – 400g,当中全谷物和杂豆类占50g-150g,薯类占50g – 100g。 按这个建议算一下,抗性淀粉(全谷类和薯类)应该占淀粉类碳水化合物的 22.2% - 71.4%,区间还挺宽的。 基因这个建议我再细化,建议抗性淀粉的比例应该靠近甚至超过上述建议区间的上限,原因下文介绍。
什么是升糖指数? 升糖指数(glycemic index或 GI)全称为“血糖生成指数”,指吃下一定量食物后,单位时间内血糖升高速度,它反映了某种食物与葡萄糖相比升高血糖的速度和能力,葡萄糖的GI是100,白糖的GI大概65, 白米饭的GI大概73。GI越高的食物,血糖升高的速度越快;GI越低,食物转化为葡萄糖的速度越慢,血糖的提升速度也越慢。GI大于60的食物包括冰淇淋、面包、面条、白米饭等。
GI低的食物由于进入肠道后停留的时间长,释放缓慢,葡萄糖进入血液后峰值较低,引起餐后血糖反应较小,需要的胰岛素也相应减少,所以避免了血糖的剧烈波动,既可以防止高血糖也可以防止低血糖,有效的控制血糖。
抗性淀粉的食物一般GI较低,谷类颗粒黏度越细,GI越高,相反全谷类的GI更低而含有的抗性淀粉则更高。
精制碳水化合物对健康不利
虽然白糖的GI(65)低于白米饭(73),但不代表白糖对身体的代谢性影响低于白米饭,理解GI需要回到果糖和葡萄糖跟血糖和胰岛素的关系:果糖不会马上增加血液中的血糖,不影响胰岛素的分泌,而白糖是双糖含有一半果糖一半葡萄糖,所以拉平均后降低了白糖的GI。
但白糖和含糖饮料(高果糖浆含有超过一半的果糖)对身体的伤害,已经众所周知不需要过多解析,这里就只举一个例子。 2011年的一项随机对照组交叉临床研究[2],29位年轻健康的受试者接受了大半年的饮食干预试验,分别每次连续3周每天饮用600ml的1)40g中等剂量果糖饮料;2)80g高剂量果糖饮料(笔者注:其实没有太“高剂量”,就等于2罐可乐含的果糖);3)40g中等剂量葡萄糖饮料;4)80g高剂量葡萄糖饮料,5)80g蔗糖饮料;和6)减少饮用果糖饮料。 受试者的健康结果当然不理想,无论是果糖还是葡萄糖,不论剂量,只需要3周的时间,低密度胆固醇载脂蛋白LDL的颗粒直径降低,这意味着增加了心血管病的发病风险;受试者的腰围同样增加了,而增加效果最明显的是果糖和蔗糖饮料。该研究证明,尽管含糖饮料只占卡路里摄入的6.5%(笔者注:世界卫生组织建议不超过10%,但最好降低于5%),在3周内已经改变了身体的代谢性指标,而且空腹血糖和炎症指标也同样增加了。研究人员觉得结果非常令人担忧(worrisome)。

美国范德堡大学的华人学者在2013年发表的一份关于中国的饮食研究[3], 跟踪了117366名上海居民5到10年的饮食和健康状况,发现当中人群的饮食中,碳水化合物占热量约68%,当中85%为精制碳水,研究发现,摄入精制碳水较多的人群,患上心血管病的风险增加2到3倍。我们都觉得咱们中国人、亚洲人没有老外这么胖,但研究指出亚洲人吃米饭为主食,在同样的BMI下,亚洲人的体脂比西方人更高,而白米饭跟糖尿病的发病率关联度也很高。 而早有研究发现进食精制碳水增加2型糖尿病的风险。[4]
我们不要以为小孩,青少年在发育时期,就可以多吃精制碳水化合物,“长点肉”才是健康发育。2014年墨西哥的一项横断研究,分析了229名青春期的少年,发现摄入高精制碳水的少年,虽然宏量营养过剩,体型肥胖,但微量营养,包括钙、维生素D、欧米茄3脂肪和镁等,严重不足,身体炎症指标都较高。研究的结论是,摄入大量的精制碳水,不管腹部脂肪是否过多,都增加胰岛素抵抗,也就是糖尿病的风险。[4]
2006年丹麦的一项队列研究[5],跟踪了22570名男性和20126名女性多年,发现总能量卡路里的摄入跟腰围的尺寸虽然没有关联性,但食用糖、精制谷物等碳水化合物跟5年后腰围的尺寸有正向关系。
由于精制碳水缺乏膳食纤维,造成血糖餐后波动大,容易摄入过多卡路里。1999年就有交叉临床试验证明了这一点[6],12名肥胖的青少年,分别无限制地食用高GI、中GI、和低GI早餐。研究发现食用高GI精制碳水时卡路里的摄入,比中GI的早餐多了53%的卡路里,比低GI早餐则高了81%的卡路里,不单如此,血糖和胰岛素都在精制碳水的一餐后升得更高。研究的结论就是,升糖指数高的精制碳水促使一系列的荷尔蒙和身体代谢变化,使到摄入的卡路里增加。
GI低的抗性淀粉饱腹感强,2003年就有研究发现[7],食用抗性淀粉可以延缓饥饿感,减少卡路里的摄入,低GI的抗性淀粉食物可能可以帮助减肥。
GI高的食物,饱腹感维持较短,2003年的一项研究发现只能维持约一小时。[8] GI低的抗性淀粉含量高的食物,饱腹感可以持续更长时间到2到3小时。

2013年的一项研究[9],解析了为何精制碳水不能供长时间的饱腹感。 12名肥胖的18-35岁男性进行交叉临床试验,分别食用低GI的抗性淀粉和高GI的精制碳水。研究发现,进食精制碳水后血糖升高比低GI的抗性淀粉高出2.4倍,进食高GI食物的4小时后血糖则比进食抗性淀粉低,饥饿感更强烈,通过MRI影像扫描发现此时大脑的右伏隔核(nucleus accumbens)开始活跃,延伸到嗅觉区(olfactory area),促使受试者继续进食。 研究的结论是,进食精制碳水1到2小时后,血糖瞬间降下来,饿的感觉随之而来,刺激中枢神经的回报机制,使我们又再想吃。
单单说精制碳水的研究可能太学术性,感觉好像没有这么直接。 2014年的一项新加坡的横断研究直接点名白米饭和面条增加糖尿病风险[10]。研究分析了2728名新加坡的华人,食用较多的白米饭和面条,不管是否增加肥胖和影响身体炎症,都加剧了胰岛素抵抗,增加血糖不耐受和空腹血糖值。
美国也有类似的研究,2004年的一项流行病学研究[11],分析了1909年到1997年接近90年的数据,发现精制碳水的摄入,加上减少膳食纤维,跟2型糖尿病在20世纪的发病有正向关系。
2013年的一项系统性回顾研究[14],包括了21个队列研究,发现升糖指数高的食物摄入越多,患上糖尿病的风险越大,而糖尿病同时增加心血管病的风险。但总碳水化合物的摄入没有发现跟糖尿病有很明显的关联性。 下图是该研究的统计分析,每天食用高GI食物越多,患上糖尿病的相对风险(RR)就越高,接近线性的正关系。
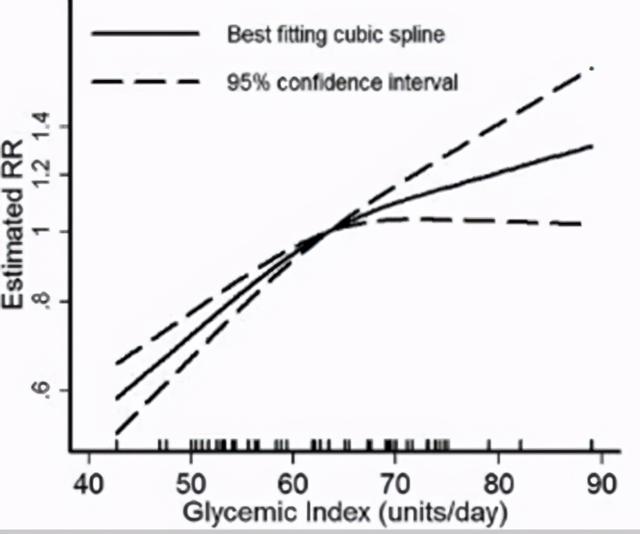
而糖尿病增加心血管病的风险,在著名的大规模流行病学研究Framingham Heart Study已经得到证明 [12],糖尿病和血糖指标跟心血管病风险是线性的正关系。
精制碳水增加身体炎症风险,2012年的一项文献回顾研究[13],发现精制碳水改变肠道菌群,增加肠癌风险,导致肠道更多的内毒素LPS,结果首先可能是肠道炎症,然后通过肠漏和脂肪的摄入,LPS被带到血液中引起身体的系统性炎症。
抗性淀粉改善健康
我们进食淀粉后,在消化系统会被分解为葡萄糖被肠道吸收,也会因此导致血糖升高。抗性淀粉不容易消化,甚至抵抗消化,所以在肠道的前端保存“完好”,缓慢消化的淀粉降低了葡萄糖的吸收,减少胰岛素的分泌和波动,同时减少了因为小肠肠道细菌过度生长(SIBO)时,肠道前端需要代谢糖的细菌。不被小肠吸收代谢的抗性淀粉,到达大肠成为膳食纤维,增加大肠中的短链脂肪酸,对改善身体的严重有好处。
2018年安徽医科大学的一项流行病学研究[21], 基于合肥健康调查,分析了当中1776名40-60岁的受试者,发现饮食中包括较多的面包和面条等食物,2型糖尿病风险增加,饮食中含有较多米线和糙米饭等,患上2型糖尿病的概率减少。侧面反映了抗性淀粉跟糖尿病的反向关系。
2019年新西兰Otago大学在《柳叶刀》发表的一项系统性回顾[15],包括了185个前瞻性研究和58个临床研究,样本超过1.35亿年人次,发现摄入最多膳食纤维的人群,全因死亡率降低15%-30%。 研究指出膳食纤维和全谷物是有协同效应的,增加全谷类食物对减少多种慢性病发病率可能是因果关系,用含有膳食纤维的全谷类取代精制淀粉谷类对改善人类健康有帮助。

抗性淀粉本身就是益生元 ,为肠道中益生菌提供食物,改善身体健康。 抗性淀粉增加肠道中的短链脂肪酸。[16] 2016年的一项双盲对照组交叉临床研究[17],20名已经出现代谢性病症的受试者接受为期26周的试验。受试者食用抗性淀粉后,最少71种肠道菌株改变了,增加了双歧杆菌等益生菌的比例,肠道中对身体有益减少炎症的中链饱和脂肪也增加了,直接对身体的影响是,空腹血糖、胆固醇和炎症指标都同时减低了。研究的结论是可发酵的抗性淀粉,改善了肠道菌群,增加短链脂肪酸和改善代谢性的健康指标,证明营养饮食干预对代谢性疾病有帮助。

上文已经提到精制碳水饱腹感降低较快,抗性淀粉则维持更长时间。2010年的一项随机交叉临床试验把饱腹感的效果展现出来了,20名健康男性受试者食用抗性淀粉食物,相对于对照组食用精制淀粉,减少了90卡路里的摄入。[20]
2004年的一项文献回顾研究指出[18], 抗性淀粉降低餐后血糖和胰岛素反应,减少血液中的胆固醇,增加饱腹感和减少脂肪在身体的积累,对减少糖尿病和心血管病风险有帮助。
2006年的一项临床试验[19],10名正常体重的女性受试者和10名肥胖的女性受试者,分别食用不同膳食纤维和抗性淀粉含量的松饼,之后分析她们代谢指标。当膳食纤维和抗性淀粉比例越高,两组受试者的血糖和胰岛素就越低。研究的结论是,抗性淀粉的食物可以降低血糖,食用膳食纤维和抗性淀粉高的食物,无论是正常体重还是肥胖的女性,都可以改善血糖代谢。
抗性淀粉在肠道中的作用接近膳食纤维,改善肠道中的菌群,增加短链脂肪酸,同时调节减少致炎症细胞因子,例如IL-1、IL-6、TNF-A等的分泌,降低身体炎症。
食物处理方法影响抗性淀粉比例
2010年山东大学的一份研究[22],我国大部分人每天摄入抗性淀粉只有14.9克。食物的烹饪方法也影响食物中的抗性淀粉含量,简单来说,熟的食物含有的抗性淀粉比生的少,炸和烤的食物中抗性淀粉比炖的抗性淀粉更多,而烹饪用来勾芡的土豆淀粉含有的抗性淀粉原来是非常高的。下图是该研究列出的几种淀粉类食物的抗性淀粉含量比例。
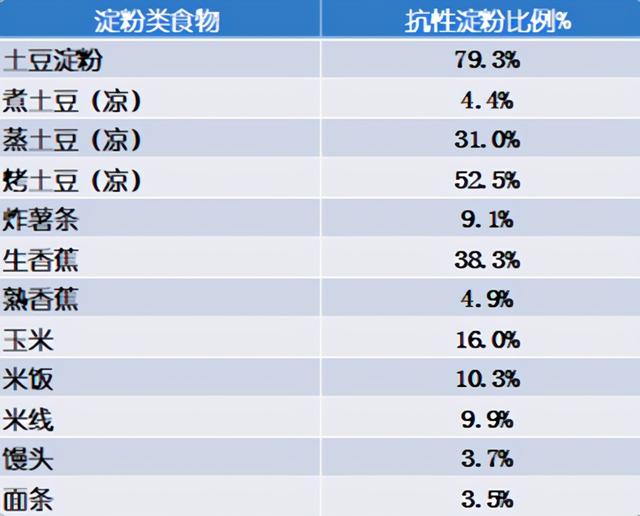
同一种食物,不同的处理方法影响食物中抗性淀粉的比例。 其中最简单增加抗性淀粉的方法是不要“趁热吃”,而是把食物先晾一会。把食物“晾一会”的过程称为“凝沉”(retrogradation)或“老化淀粉”。[23]
淀粉在加热后结构改变了,但在冷却后又再作改变,例如土豆在生的时候,抗性淀粉含量非常高,达到72%,但煮熟后就大幅减少,冷却后又会增加一部分。[24] 冷却后的淀粉结构可以减慢消化,有对身体的整体健康都有帮助。
就算你不习惯吃凉的食物,冷却后重新适度加热的高淀粉食物,抗性淀粉还是保存得较好的。印度尼西亚大学在2015年的一项随机对照组交叉临床研究[25],测试刚煮熟的米饭和隔夜饭的抗性淀粉含量,分别对人体的影响。 研究分析了 新鲜热米饭(对照组),室温放置10小时的米饭(测试1组),和放置在冰箱4度环境下24小时然后重新加热的米饭(测试2组)。研究发现测试1组的米饭含抗性淀粉是对照组的2倍,测试2组的米饭含抗性淀粉是对照组的2.5倍。 15名健康的受试者之后接受随机对照组交叉试验,食用测试2组米饭的受试者的血糖显著低于吃新鲜热饭的对照组。研究的结论是,食用放置在4度下24小时再加热的米饭,相对新鲜热米饭,减少了对身体的血糖影响。
上面印尼的学者对米饭感兴趣,老外对土豆的兴趣大一些,1999年就有研究发现同样置于4度一个晚上,第二天的土豆,抗性淀粉增加2.8倍。[26] 临床研究也发现研究[27],食用抗性淀粉较高的土豆,相比对照组,血糖升高较少。
总结
精制碳水化合物增加炎症和代谢性疾病的风险,在不改变淀粉类食物在热量占比下,用抗性淀粉取代精制碳水,可以减少炎症和代谢性疾病。 全谷物和薯类淀粉在适当处理下,都是不错的抗性淀粉,应该占饮食中淀粉的70%以上。
烹饪和处理食物的方法直接影响食物中有利健康的抗性淀粉含量,其实看完上述的研究,大家可能都已经得出一个结论,越是“难吃”的淀粉食物,抗性淀粉就越高:
- 糙米饭和粗粮比白米饭和细粮的抗性淀粉要高;
- 冷饭、隔夜饭比新鲜热气腾腾的白米饭抗性淀粉更高;
- 冷却后的土豆比热的土豆的抗性淀粉更高;
- 生的水果例如生香蕉比熟的香蕉抗性淀粉更高;
- 你很喜欢的馒头、面条、白面包抗性淀粉都是低的;
- 夏天一罐冰冻的可乐直接就把你血糖和心血管病风险“带飞”了…….
本文内容仅作为科普知识提供,不能代替医生的治疗诊断和建议。文章内容中涉及医学的部分均来源于参考文献。
参考
[1] 中国营养学会(2016),中国居民膳食指南(2016版)[M],北京:人民卫生出版社
[2] Aeberli, I., Gerber, P. A., Hochuli, M., Kohler, S., Haile, S. R., Gouni-Berthold, I., Berthold, H. K., Spinas, G. A., & Berneis, K. (2011). Low to moderate sugar-sweetened beverage consumption impairs glucose and lipid metabolism and promotes inflammation in healthy young men: a randomized controlled trial. The American journal of clinical nutrition, 94(2), 479–485. https://doi.org/10.3945/ajcn.111.013540
[3] Yu, D., Shu, X. O., Li, H., Xiang, Y. B., Yang, G., Gao, Y. T., Zheng, W., & Zhang, X. (2013). Dietary carbohydrates, refined grains, glycemic load, and risk of coronary heart disease in Chinese adults. American journal of epidemiology, 178(10), 1542–1549. https://doi.org/10.1093/aje/kwt178
[4] López-Alarcón, M., Perichart-Perera, O., Flores-Huerta, S., Inda-Icaza, P., Rodríguez-Cruz, M., Armenta-Álvarez, A., Bram-Falcón, M. T., & Mayorga-Ochoa, M. (2014). Excessive refined carbohydrates and scarce micronutrients intakes increase inflammatory mediators and insulin resistance in prepubertal and pubertal obese children independently of obesity. Mediators of inflammation, 2014, 849031. https://doi.org/10.1155/2014/849031
[5] Halkjaer, J., Tjønneland, A., Thomsen, B. L., Overvad, K., & Sørensen, T. I. (2006). Intake of macronutrients as predictors of 5-y changes in waist circumference. The American journal of clinical nutrition, 84(4), 789–797. https://doi.org/10.1093/ajcn/84.4.789
[6] Ludwig, D. S., Majzoub, J. A., Al-Zahrani, A., Dallal, G. E., Blanco, I., & Roberts, S. B. (1999). High glycemic index foods, overeating, and obesity. Pediatrics, 103(3), E26. https://doi.org/10.1542/peds.103.3.e26
[7] Roberts S. B. (2003). Glycemic index and satiety. Nutrition in clinical care : an official publication of Tufts University, 6(1), 20–26.
[8] Anderson, G. H., & Woodend, D. (2003). Effect of glycemic carbohydrates on short-term satiety and food intake. Nutrition reviews, 61(5 Pt 2), S17–S26. https://doi.org/10.1301/nr.2003.may.S17-S26
[9] Lennerz, B. S., Alsop, D. C., Holsen, L. M., Stern, E., Rojas, R., Ebbeling, C. B., Goldstein, J. M., & Ludwig, D. S. (2013). Effects of dietary glycemic index on brain regions related to reward and craving in men. The American journal of clinical nutrition, 98(3), 641–647. https://doi.org/10.3945/ajcn.113.064113
[10] Zuñiga, Y. L., Rebello, S. A., Oi, P. L., Zheng, H., Lee, J., Tai, E. S., & Van Dam, R. M. (2014). Rice and noodle consumption is associated with insulin resistance and hyperglycaemia in an Asian population. The British journal of nutrition, 111(6), 1118–1128. https://doi.org/10.1017/S0007114513003486
[11] Gross, L. S., Li, L., Ford, E. S., & Liu, S. (2004). Increased consumption of refined carbohydrates and the epidemic of type 2 diabetes in the United States: an ecologic assessment. The American journal of clinical nutrition, 79(5), 774–779. https://doi.org/10.1093/ajcn/79.5.774
[12] Fox C. S. (2010). Cardiovascular disease risk factors, type 2 diabetes mellitus, and the Framingham Heart Study. Trends in cardiovascular medicine, 20(3), 90–95. https://doi.org/10.1016/j.tcm.2010.08.001
[13] Spreadbury I. (2012). Comparison with ancestral diets suggests dense acellular carbohydrates promote an inflammatory microbiota, and may be the primary dietary cause of leptin resistance and obesity. Diabetes, metabolic syndrome and obesity : targets and therapy, 5, 175–189. https://doi.org/10.2147/DMSO.S33473
[14] Greenwood, D. C., Threapleton, D. E., Evans, C. E., Cleghorn, C. L., Nykjaer, C., Woodhead, C., & Burley, V. J. (2013). Glycemic index, glycemic load, carbohydrates, and type 2 diabetes: systematic review and dose-response meta-analysis of prospective studies. Diabetes care, 36(12), 4166–4171. https://doi.org/10.2337/dc13-0325
[15] Reynolds, Andrew & Mann, Jim & Cummings, John & Winter, Nicola & Mete, Evelyn & Morenga, Lisa. (2019). Carbohydrate quality and human health: a series of systematic reviews and meta-analyses. The Lancet. 393. 10.1016/S0140-6736(18)31809-9.
[16] Wong, J. M., de Souza, R., Kendall, C. W., Emam, A., & Jenkins, D. J. (2006). Colonic health: fermentation and short chain fatty acids. Journal of clinical gastroenterology, 40(3), 235–243. https://doi.org/10.1097/00004836-200603000-00015
[17] Upadhyaya, B., McCormack, L., Fardin-Kia, A. R., Juenemann, R., Nichenametla, S., Clapper, J., Specker, B., & Dey, M. (2016). Impact of dietary resistant starch type 4 on human gut microbiota and immunometabolic functions. Scientific reports, 6, 28797. https://doi.org/10.1038/srep28797
[18] Higgins J. A. (2004). Resistant starch: metabolic effects and potential health benefits. Journal of AOAC International, 87(3), 761–768.
[19] Behall, K. M., Scholfield, D. J., Hallfrisch, J. G., & Liljeberg-Elmståhl, H. G. (2006). Consumption of both resistant starch and beta-glucan improves postprandial plasma glucose and insulin in women. Diabetes care, 29(5), 976–981. https://doi.org/10.2337/diacare.295976
[20] Bodinham, C. L., Frost, G. S., & Robertson, M. D. (2010). Acute ingestion of resistant starch reduces food intake in healthy adults. The British journal of nutrition, 103(6), 917–922. https://doi.org/10.1017/S0007114509992534
[23] Haralampu, Stephen. (2000). Resistant starch: A review of the physical properties and biological impact of RS3. Carbohydrate Polymers. 41. 285-292. 10.1016/S0144-8617(99)00147-2.
[24] Wang, Shujun & Li, Caili & Copeland, Les & Niu, Qing & Wang, Shuo. (2015). Starch Retrogradation: A Comprehensive Review. Comprehensive Reviews in Food Science and Food Safety. 14. 10.1111/1541-4337.12143.
[25] Wang, Shujun & Li, Caili & Copeland, Les & Niu, Qing & Wang, Shuo. (2015). Starch Retrogradation: A Comprehensive Review. Comprehensive Reviews in Food Science and Food Safety. 14. 10.1111/1541-4337.12143.
[26] Zhou, Jielin & Sheng, Jie & Fan, Yong & Zhu, Xingmeng & Wang, Sufang. (2018). Dietary patterns, dietary intakes and the risk of type 2 diabetes: results from the Hefei Nutrition and Health Study. International Journal of Food Sciences and Nutrition. 70. 1-9. 10.1080/09637486.2018.1515184.
[27] Chen, L., Liu, R., Qin, C., Meng, Y., Zhang, J., Wang, Y., & Xu, G. (2010). Sources and intake of resistant starch in the Chinese diet. Asia Pacific journal of clinical nutrition, 19(2), 274–282.



















评论