4+7大品种 最强竞品来了
作者:赛柏蓝
▍来源: 赛柏蓝 特约撰稿:阿托品
2019年9月,印度瑞迪博士实验室的奥氮平片已经进入“制证完毕-待发批件”阶段,虽然CDE的通过一致性评价信息尚未公布其正式通过一致性评价的信息,但是业内人士已经透露该产品非常大的可能性将通过一致性评价,这也是印度瑞迪在华申报的一致性评价产品。 2019年7月该司申报了硫酸氢氯吡格雷片的一致性评价补充申请,其硫酸氢氯吡格雷片在2018年上市。
奥氮平不是首个通过一致性评价的进口仿制药,首个通过一致性评价的进口仿制药是诺华的瑞舒伐他汀钙片,除了诺华之外还有阿斯利康、鲁南贝特、浙江海正、浙江京新、正大天晴、先声东元多家企业竞争三家中标的资质,预计竞争激烈。
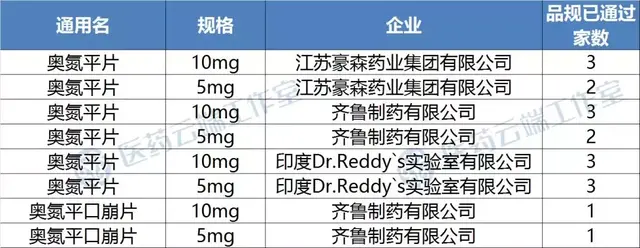
奥氮平口服常释剂型目前符合“4+7”扩面联盟带量采购要求的企业仅礼来、山东齐鲁、江苏豪森三家,如果印度瑞迪博士的一致性评价批件在2019年9月24日就有望争取进入联盟采购,只要价格不高于豪森在“4+7”的报价,就有望三家内中标,有望成为仿制药带量采购首个中标的印度进口仿制药。
2018年7月9日,中国外交部发言人华春莹表示,中印双方就推动印度药品进入中国市场、开展中印医药产业对话交流合作进行着良好沟通。 有关部门就开展中印双边医药贸易合作及促进扩大印度药品进入中国市场等制定了具体措施。
至此,中国医药企业开始频频和印度企业合作。
2018年以前,印度进口中国主要是原料药为主,制剂在中国上市的甚少。 2018年10月国内临床默许制度实施,一直在排队的印度仿制药获批临床默许,例如印度太阳的依托考昔片,印度瑞迪博士的普瑞巴林胶囊。 临床默许制将加快印度仿制药的审批时间,也让印度药企更有动力在华申报产品。
根据网络排名,印度排名前五的分别为印度太阳制药、鲁宾制药、印度瑞迪博士、西普拉、阿拉宾度。 除了鲁宾制药还没有对外公布和中方企业的合作计划外,其余4家企业都找到中国的合作方。
No.1 太阳制药
2019年6月27日,康哲药业通过其全资附属公司与太阳制药(Sun Pharmaceutical Industries Ltd.)之全资附属公司就其两个产品 Tildrakizumab(一种用于银屑病及银屑病性关节炎的创新生物治疗产品)和 0.09% 环孢菌素A滴眼液(一种用于治疗干眼症的创新治疗产品)分别签订了许可协议,获得了两个产品在大中华地区(包括中国大陆、香港特别行政区、澳门特别行政区和台湾)开发与商业化上述两个产品的独家的、可分许可的许可权利。
协议的初始期间为产品在区域首次上市销售起算十五年。 2019年8月,康哲药业再次通过其全资附属公司与太阳制药就其七个仿制药产品签订了许可协议,获得了根据太阳制药的知识产权和注册文件在中国大陆开发与商业化产品的独家的、可分许可的权限。 协议的初始期间为产品在区域内首次上市销售起算二十年。
No. 3 印度瑞迪博士
2018年8月21日,常山药业与印度瑞迪博士(Dr.Reddy’s Laboratories)签署购买协议。 公司拟出资60万美元购买印度瑞迪博士公司苯磺酸氨氯地平、枸橼酸西地那非两种药品在美国的注册批件及相关技术资料。
2019年印度瑞迪博士申报了碳酸司维拉姆片,瑞迪博士(无锡)和印度MSN 联合申报了地拉罗司分散片。
No.4 西普拉
2019年7月17日西普拉(Cipla EU)与江苏创诺制药有限公司(“创诺”)已达成协议,在中国成立一家价值3000万美元的合资公司,将西普拉的仿制药带入中国市场。 西普拉将投入80%的资金并持有合资公司80%股份。 合资公司成立后,将在当地设立呼吸科产品生产设施。 这是双方的第二度合作,早在2004年西普拉就与上海创诺医药集团合资成立了江苏希迪制药。 2014年西普拉将股份出售退出合资公司,江苏希迪而后改名江苏创诺。
No. 5 宾度
2018年12月23日,山东罗欣药业股份有限公司宣布公司与印度阿拉宾度制药有限公司(Aurobindo Pharma)签订战略合作协议,双方将共同在中国设立合资公司,联合投资研发和生产体系以引进呼吸领域产品。 阿拉宾度制药将通过合资公司把更多具有技术壁垒的呼吸领域产品及技术转移到中国,并且实现本地化生产; 合资公司将拥有众多已在美国以及欧洲获取上市批件的产品,未来将持续给中国、美国及欧洲市场供货。
2019年,阿拉宾度制药有限公司和安若维他药业泰州有限公司共同申报了非那雄胺片、苯磺酸氨氯地平片和硫酸氢氯吡格雷片。
除了印度排名前列的企业合作,我国制药企业也和印度领先企业启动深度合作。
2019年7月29日,四环医药宣布其全资子公司耀忠国际(香港)有限公司已与印度仿制药企业Strides Pharma Science Limited之全资子公司Strides Pharma Global Pte Limited签订战略合作协议,共同成立合资公司,积极开拓中国仿制药的医药市场,进一步巩固并扩大市场份额。 根据协议,耀忠国际与Strides新加坡子公司各占合资公司51%及49%股权,该合资公司将获得独家授权在中国注册申报、商业化及分销Strides Limited制造生产的4个产品。
电影《我不是药神》中印度格列宁的原型厂家Natco Pharma也打算正式进入中国市场。 2019年3月份曾有消息传出Natco Pharma将与中国机构合作,启动吉非替尼的BE临床试验。 鉴于目前进口仿制药以5.2类申报,BE研究一般是默许制,但尚未查到Natco申报吉非替尼临床的信息。 咸达数据V3.5发现2019年8月Natco分别和杭州泰格、江苏杜瑞申报了注射用阿扎胞苷和碳酸镧咀嚼片。
印度阿兰比克制药Alembic Limited和埃地亚(上海)医药2019年申报了缬沙坦氨氯地平片(Ⅱ)和塞来昔布胶囊。
小结
印度药企和国内药企的合作方式主要有二,一种是成立共同合资公司,另一种则是签订许可协议,让中国企业运作产品。
如果申报顺利,2020年会有越来越多的印度产品在中国上市,根据目前“4+7”扩面联盟采购的规定,印度的仿制药非常有可能会与国内企业平分市场,而且进入国内的印度企业是国际化高并且在印度排名前列的当地大企业,提供的产品是,质量被FDA认可且价格便宜的仿制药,国内仿制药企业准备好面临外来的挑战了吗?
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:[email protected])



















评论