GSK肿瘤药物美国撤销上市程序!热门赛道国内市场何去何从?
葛兰素史克(GSK)日前对外宣布,已根据美国FDA要求,启动BCMA ADC药物Blenrep(belantamab mafodin-blmf)在美国的撤销上市程序。该请求基于先前公布的DREAMM-3 III期验证性试验结果,该结果不符合FDA加速批准规定的要求。

据了解,11月7日,也就是此次宣布撤市的15天前,DREAMM-3 研究的失败结果正式公布,这表明Blenrep撤市程序启动的决定可谓十分果断和迅速;加之监管方面近期采取的一系列动作,从中不难感受到,美国FDA的加速批准通道规则正在发生变化,引起业界广泛关注。
值得注意的是,今年5月,Blenrep作为特许药械落地中国海南博鳌超级医院,并被纳入乐城全球特药险,本次Blenrep在美国启动撤销上市程序,该产品在中国市场的研发进程将可能发生怎样的变化?
临床结果引发连锁反应 FDA加速批准规则生变
Blenrep 是一款靶向BCMA(B细胞成熟抗原)的抗体药物偶联物(ADC),于2020年8月先后获得FDA和EMA的批准,单药治疗先前接受过至少四种疗法(包括抗CD38单抗、蛋白酶体抑制剂和免疫调节剂)的多发性骨髓瘤(MM)患者。
MM是一种仅次于非霍奇金淋巴瘤的第二大常见血液学恶性肿瘤。起初,MM的治疗方式主要为化疗、蛋白酶体抑制剂和免疫调节剂等,但疗效有限,疾病复发不可避免。在BCMA被发现是MM的关键诊断标志物和治疗靶点后,围绕该靶点、针对MM和其他血液系统恶性肿瘤的药物研发迎来了“黄金时代”。
GSK开发的Blenrep是全球首个上市的ADC技术路线的BCMA靶点产品,自2020年获批以来,该产品的市场销售开始攀升,去年已经实现了8900万英镑的全球销售额,其中约三分之二的销售贡献来自美国市场。
由于是通过美国FDA加速批准的途径上市的,这款产品在上市后需要继续进行验证性临床试验,这也就为本次撤市埋下了伏笔。Blenrep获得FDA的加速批准是基于DREAMM-2的ORR、DOR数据,同时也取决于随机III期临床试验验证的临床结果。DREAMM-3研究也就是本次涉及撤市的临床试验,是一项“头对头”的优效性试验:评估Blenrep单药与泊马度胺(pomalidomide)联合低剂量地塞米松(PomDex)的疗效对比。
在该研究中,该项研究并未达到无进展生存期(PFS)这一主要临床终点。次要终点包括总反应率(ORR)、缓解持续时间(DOR)和总生存期(OS)。Blenrep和地塞米松的ORR分别为41%和36%;12个月的DOR率分别为76.8%和48.4%。此外,Blenrep的安全性与耐受性与先前一致,没有发现新的安全信号。
市场观点分析认为,该药撤市原因在于没能满足加速批准的主要要求。美国FDA在1992年设立了加速批准程序:
针对治疗严重疾病、相对于现有的治疗方法具有重要治疗优势的药物,可采用可能预测临床益处的合理替代终点或中间临床终点作为审评依据来加速药物的批准。通过加速批准上市之后,制药公司仍需要进行试验,证实药物的临床益处。如果确证性试验无法有效证明临床益处,FDA可撤回批准。
近年来,美国FDA开始改变加速批准态度,阿斯利康、GSK、Clovis等都有产品被撤下加速批准的适应症。本次GSK如此迅速将Blenrep撤市,难免印证了美国FDA关于加速批准通道的强势举措。
GSK首席医疗官Sabine Luik表示公司不会放弃Blenrep,将继续推进相关临床试验并与FDA合作,为MM患者提供治疗方案;此外,GSK方面还透露,关于Blenrep的两项III期试验DREAMM-7和DREAMM-8研究结果预计将于2023年上半年公布。
据媒体信息披露,虽然Blenrep本次启动撤销上市程序,或将导致该产品在美国市场短期内遭遇巨大冲击,但是,Blenrep在欧盟十余个国家仍将继续销售。
血液肿瘤硝烟弥漫 细分赛道竞争加剧
今年5月,Blenrep正式落地中国海南博鳌超级医院,按临床急需药品批准进口使用,并被纳入乐城全球特药险。本次Blenrep被FDA要求撤市的理由是基于临床试验不及预期和安全性没有突破的考量,这是否将会影响Blenrep在海南博鳌的临床使用?该产品在中国的研发进程又会遭遇怎样的挑战?对此,《医药经济报》新媒体中心就相关问题向GSK中国采访求证,但截止发稿暂未收到回应。
实际上,在BCMA ADC上失败的不止GSK,2021年4月,阿斯利康因为视力损害太大的副作用叫停相关药物MEDI2228在MM中的Ⅱ期临床试验。安进同样因为安全性问题,放弃尚在Ⅰ期临床的AMG 224。目前,全球在研的BCMA ADC所剩无几。
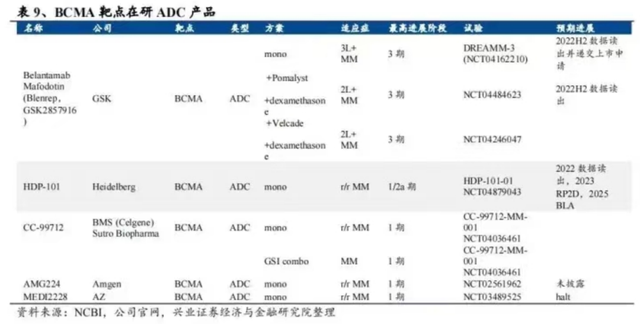
值得一提的是,今年2月,华东医药斥资1.05亿欧元取得德国Heidelberg Pharma公司35%股权,同时获得了治疗MM的BCMA ADC产品HDP-101在中国大陆及港澳台地区、韩国、新加坡等20个亚洲国家和地区的独家许可,包括独家开发及商业化权益。目前没有太多相关数据公布,未来的临床前景尚需观察。
另一方面,针对BCMA靶点,双抗、CAR-T等细分领域的探索还在继续。据不完全统计,目前全球在研靶向BCMA的双抗有17款,还有4款为三抗,不过,临床试验的风险和挑战依然不容忽视。
辉瑞在2021年暂停其BCMA/CD3双特异性抗体Elranatamab的Ⅱ期临床试验MagnetisMM-3的患者招募,原因是临床试验中发生3例外周神经损伤;安进的两款BCMA双抗AMG 420、AMG 701也同样被叫停。
但也有好消息,今年8月,强生的teclistamab在欧盟附条件批准,成为全球首个上市的BCMAxCD3双抗;不到两个月,该药又在美国获得加速批准。
在国内,目前布局BCMA双抗的企业包括有百济神州、信达生物、康诺亚、岸迈生物、安源生物等近10家企业。其中,康诺亚、岸迈生物进展最快,进入临床I/II期阶段,百济神州亦引进了两款产品。
在CAR-T领域,目前上市情况更为可观,已有2款BCMA CAR-T疗法获批上市,分别为百时美施贵宝(BMS)和蓝鸟生物(Bluebird)联合研发的 Abecma,以及传奇生物和杨森公司合作开发的 Carvykti(西达基奥仑赛)。此外,国内还将有两款产品即将上市,分别为驯鹿生物和信达生物合作开发的伊基仑赛,以及科济药业的泽沃基奥仑赛。
研发管线方面,据不完全统计,全球目前有63款在研BCMA靶向CAR-T产品,其中以国内研发企业/机构进行开发的产品居多,在竞争加剧的产业语境下,国内创新制药企业想要突破重围并不容易。业内人士表示,国内企业更倾向于选择在CAR-T领域上下功夫,在更有把握的情况下开发新药,这固然保障了一定的成功率,但也加速了该赛道的同质化风险。
记者:于成林
编辑:陈淑文

















评论