南洋理工大学Shingo Ito博士近年来工作概览
本文来自微信公众号:X-MOLNews
Shingo Ito(伊藤慎庫)博士本硕博阶段均就读于东京大学,2003年获得学士学位,2005年获得硕士学位,2008年获得博士学位,其导师为Eiichi Nakamura教授。2008年至2018年,Shingo Ito博士任教于东京大学(UTokyo)化学与生命科学系,2018年至今,在新加坡南洋理工大学(NTU)化学与生物系任助理教授(PI)。Shingo Ito博士的研究兴趣主要集中在两个方向:(1)发展新的方法来构建C-C键,从而获得共轭小分子以及共轭聚合物;(2)设计并合成新型的含杂原子的π共轭分子。例如,Shingo Ito博士及其团队近期合成了一种稠环芳烃类的亚甲胺叶立德试剂,通过该试剂与其他亲电试剂的1,3-偶极环加成,构建一系列含氮的平面以及碗状分子。本文主要介绍Shingo Ito博士于东京大学及南洋理工大学工作期间在氮杂稠环芳烃方面的主要工作。

Shingo Ito(伊藤慎庫)博士。图片来源:ITO Group / NTU
(一)新型亚甲胺叶立德试剂的合成
1,3-偶极子与不饱和的亲偶极组分之间的环加成反应作为用来构建五元杂环的不可或缺的手段,同时由于其反应的多样性以及高效性,获得了较多的关注。在这其中,亚甲胺叶立德试剂由于可用于合成吡咯烷以及吡咯类化合物(许多天然产物以及药物的重要中间体)则显得尤为特别。然而,目前只有极少数的亚甲胺叶立德试剂被合成和报道。2015年Shingo Ito博士等人报道了一类新型的亚甲胺叶立德试剂(Chem. Commun., 2015, 51, 221-224),可与其他的亲电试剂(烯基类、炔基类)进行1,3-偶极环加成反应从而高效获得相应的(多芳基取代)吡咯类化合物。这也为该团队后续合成氮杂稠环芳烃分子奠定了基础。值得注意的是,该文投稿期间,冯新亮教授团队也报道了相同的亚甲胺叶立德试剂(Angew. Chem. Int. Ed., 2014, 53, 10520)。

图1. 新型亚甲胺叶立德试剂与亲电试剂的反应。图片来源:Chem. Commun.
(二)氮杂苯并碗烯的合成
碗状的稠环芳香分子,如碗烯(corannulene)、素馨烯(sumanene),具有独特的几何特征,且可被看作富勒烯和碳纳米管的片段,因此吸引了许多化学家去研究它们的结构对性质的影响以及综合性能,同时也付出大量的努力去合成各种碗状芳香分子及其衍生物。然而,具有杂原子的碗状分子却鲜有报道。此前仅有sumanene的杂原子衍生物被合成出来,而且这些杂原子皆位于sumanene分子边缘结构上(图2a);含杂原子的corannulene由于合成难度大,因此人们对它的了解大多存在于理论计算中。2015年,Shingo Ito博士等人合成并制备了一种新颖的氮杂苯并碗烯分子(图2b),且氮原子位于碗烯分子的中心(Angew. Chem. Int. Ed., 2015, 54, 7256)。利用之前发展的新型亚甲胺叶立德试剂与亲电试剂(二芳基炔)进行1,3-偶极环加成反应,随后再通过分子内的Heck反应进行关环,最后得到了氮杂苯并碗烯分子,其晶体结构分析显示固态时该分子呈现碗-碗的堆叠方式(bowl-in-bowl π-stacking, 图2c)。同样值得关注的是Hiroshi Shinokubo教授课题组在同一年用不同的方法合成并报道了同样的氮杂苯并碗烯分子(Nat. Commun., 2015, 6, 8215)。
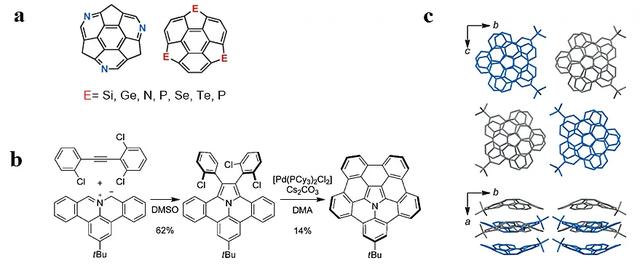
图2. a)杂原子掺杂的sumanene; b) 氮杂苯并碗烯的合成;c) 氮杂苯并碗烯的堆叠结构。图片来源:Angew. Chem. Int. Ed.
(三)碗烯的环加成反应
自从1966年被首次合成之后,碗烯由于具有高度对称性(C5v对称轴)、独特的拓扑结构以及电学性质,在有机电子器件、分子识别以及超分子组装等领域有着广泛的应用潜力。研究者们也因此进行了很多碗烯后功能化的工作。如图3所示,人们对碗烯的边缘双键进行了取代反应(图3a)、加成反应(图3b)以及钯催化的annulative π-extensions反应(图3e),对处于辐条(spoke)位置的双键进行了加成(图3c)以及环加成反应(图3d)。尽管有理论预测表明碗烯的边缘双键可进行{4π+2π}型环加成(图3f),然而对该位置的环加成反应几乎没有实验报道。2017年,Shingo Ito博士等人首次报道了利用芳香亚甲胺试剂与碗烯的边缘双键进行1,3-偶极环加成反应,生成了相应的单、双重加成产物,随后再用DDQ(2,3-二氯-5,6-二氰基苯醌)进行芳构化,最后得到了吡咯连接的碗烯分子(图3g)(Angew. Chem. Int. Ed., 2017, 56, 15560)。光谱研究显示,相比于原来的碗烯分子,它们的吸收峰由于π体系的扩展发生了红移,且都表现出了明显的溶剂化效应:随着溶剂极性的增加,其发射光谱也发生了红移。
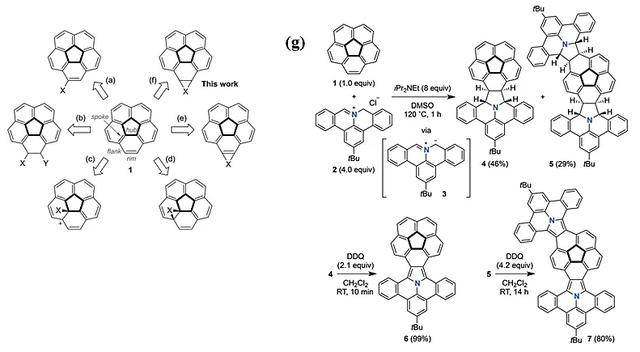
图3. a-f) 碗烯的后功能化反应; g) 碗烯的环加成反应。图片来源:Angew. Chem. Int. Ed.
(四)高曲率氮杂巴基碗分子的合成
Corannulene和sumanene等分子作为π共轭稠环芳烃,可被看作富勒烯分子片段。由于富勒烯又称“巴基球”(buckyball),这些碗状分子也被称为“巴基碗”(buckybowls)。为了更好的探索类富勒烯分子的物化性质,研究者们尝试合成并分离具有更大以及更弯曲π表面的巴基碗分子,以及向sp2的碳结构网络引入杂原子(如氮、硼)以改变分子的物化性质。此前大部分报道的杂原子掺杂的巴基碗分子局限于C60-xEx (E=杂原子,图4a),更高heterofullerenes却少有报道。2018年Shingo Ito博士等人再次利用亚甲胺叶立德试剂与corannulene的1,3-偶极环加成反应随后再进行Heck反应进行分子内关环(图4c),最终得到了目标巴基碗分子(图4b中8a, 8b分子,Angew. Chem. Int. Ed., 2018, 57, 9818),此分子可被视为corannulene和氮杂corannulene的杂化体。同时单晶结构显示该分子具有非常弯曲的碗状结构,最大的曲率几乎和C60富勒烯分子相当。
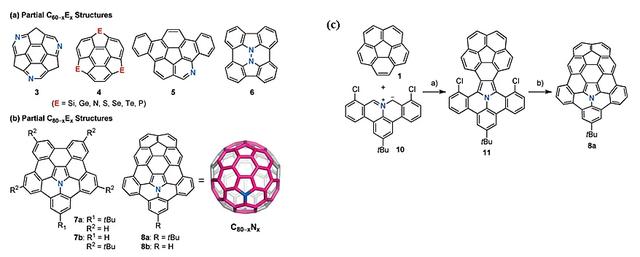
图4. a-b) 含杂原子的巴基碗分子; c) 巴基碗分子的合成。图片来源:Angew. Chem. Int. Ed.
(五)氮杂[8]环烯的合成
[8]环烯:中心为八元环,边缘被八个苯环所环绕,由于其楔角总和达到了480°,因此分子存在较大的环张力。同时[8]环烯的马鞍形结构特征,有望被用于构建具有负曲率的(纳米)石墨烯。尽管[8]环烯及其苯并衍生物被陆续报道,但是具有杂原子的非平面构型的[8]环烯受限于较大的合成难度,仍然鲜有报道。如图5a中的化合物2和3,虽然中心为八元环,但由于边缘连接了较多的五元杂环,楔角总和较小,因此分子结构均为平面或接近平面的构型。2020年,Shingo Ito博士等人结合1,3-偶极环加成反应和表面合成法,制备并报道了π扩展的氮杂[8]环烯(图5化合物4),该分子边缘具有6个苯环以及两个氮杂五元环(J. Am. Chem. Soc., 2020, 142, 11363)。该团队结合扫描隧道显微镜(STM)和密度泛函理论(DFT)计算,证实了分子4a(图5b)相对于平面(12.7 kJ/mol)和马鞍形(2.7 kJ/mol)的构型,其扭曲的构型最为稳定。同时核独立化学位移(NICS)和各向磁感应电流密度(ACID)分析结果表明,分子中心的八元环具有反芳香性特征,周围的苯环和吡咯环皆展现出芳香性。
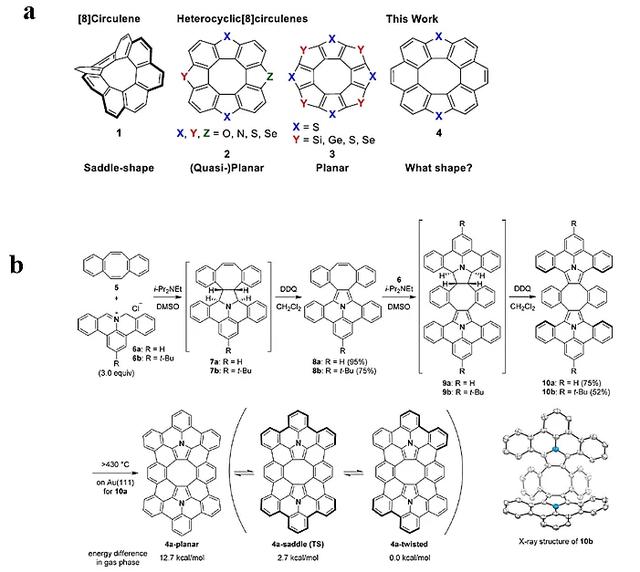
图5. a) [8]环烯及含杂环的[8]环烯衍生物; b) 氮杂[8]环烯的合成。图片来源:J. Am. Chem. Soc.






















评论