FDA批准罗氏PD-L1免疫抑制剂泰圣奇联合安维汀用于治疗肝细胞癌
--泰圣奇联合安维汀是首个且目前唯一获批用于不可切除肝细胞癌治疗的肿瘤免疫疗法
--与之前的标准疗法相比,泰圣奇联合疗法在总生存期和无进展生存期方面均有改善
--该申请通过FDA的“Orbis试点项目”和肿瘤产品实时审评(Real-Time Oncology Review)程序获得了批准
近日,美国食品药品监督管理局(FDA)批准PD-L1免疫抑制剂泰圣奇®(英文名:Tecentriq®,通用名:阿替利珠单抗)联合安维汀®(英文名:Avastin®,通用名:贝伐珠单抗)用于既往未接受过系统治疗的不可切除肝细胞癌患者。
获批的主要依据是全球多中心III期临床试验IMbrave150的研究结果。研究显示,对比索拉非尼,泰圣奇®联合安维汀®能显著降低死亡风险42%(OS分层HR=0.58; 95% CI: 0.42-0.79; p=0.006),显著降低疾病进展和死亡风险41%(PFS分层HR=0.59; 95% CI: 0.47-0.76; p<0.0001),患者的12个月生存率提高到67.2%。IMbrave150是第一个显示可比索拉非尼更好改善不可切除肝细胞癌患者总生存期(OS)和无进展生存期(PFS)的III期肿瘤免疫疗法研究。在泰圣奇®联合安维汀®组,有38%的患者出现严重不良反应(3/4级),最常见的严重不良反应(≥2%)是胃肠道出血、感染和发热。上述结果都已于2020年5月14日发表于《新英格兰医学杂志》1。
“泰圣奇®联合安维汀®的免疫治疗方案获得批准,为肝细胞癌这种侵袭程度很高的癌症带来了新的治疗选择,我们对此感到非常兴奋。”罗氏首席医学官兼全球产品开发负责人Levi Garraway博士表示。“通过FDA肿瘤产品实时审评(Real-Time Oncology Review,简称RTOR)程序和‘Orbis试点项目’的审核,这一新兴疗法有望更快为美国及全球患者服务。”
“晚期肝癌是死亡率不断攀升、一线治疗选择非常有限的癌种之一。IMbrave150的研究结果对晚期肝癌患者有着极其重要的意义。”加州大学洛杉矶分校大卫•格芬医学院教授兼琼森综合癌症中心信号传导与治疗项目主任Richard Finn博士表示。“对比自2007年起就成为肝细胞癌一线疗法的索拉非尼,这是第一个能更加显著地改善患者生存率的疗法。良好的耐受性也有助于实现更好的疾病控制。”
此次审核根据FDA的“Orbis试点项目”进行,该计划为国际合作伙伴之间同步提交和审批肿瘤药物提供了框架支持。FDA认为2,鉴于不同国家递交审批文件的时间可能存在显著差异,国际监管机构之间可通过合作让癌症患者尽早获取新药。罗氏根据该项目同时在美国、澳大利亚、加拿大和新加坡提交了申请。此外,FDA还根据RTOR程序快速审核并通过了这一申请。RTOR旨在探索一种更高效的审核流程,确保安全有效的疗法可以尽早惠及患者。
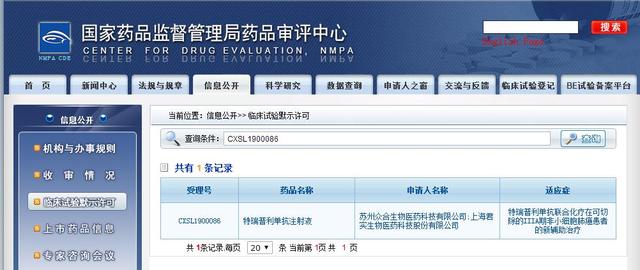
在中国,罗氏于2020年1月就泰圣奇®联合安维汀®用于一线治疗晚期不可切除的肝细胞癌向中国药品监督管理局提交了上市申请,并于2月28日被正式授予优先审评资格。在早前的2月7日,罗氏在欧洲肝脏研究协会(EASL)主办的2020年肝癌峰会(Liver Cancer Summit)公布了IMbrave 150的中国亚群数据研究结果3。参加IMbrave150研究的194名中国患者的数据显示,与现有标准治疗方案相比,泰圣奇®联合安维汀®方案在总生存期(OS)和无进展生存期(PFS)方面均具有临床意义的改善,总生存期(OS)改善较IMbrave150全球数据更为显著。在癌细胞癌发病率和死亡率都较高的中国,相当数量的患者在确诊时已处于中晚期,失去了手术或其他局部治疗的机会,即使可以手术或局部治疗,也常会复发转移。一旦这一创新免疫联合疗法在中国获得正式批准,将极大满足肝细胞癌患者的未尽之需。
罗氏为泰圣奇®制定了广泛的临床开发计划,其中包括多项正在进行和计划进行的III期研究,涵盖肺癌、生殖泌尿癌、皮肤癌、乳腺癌、胃肠癌、妇科癌症和头颈癌,包括旨在评估泰圣奇®单药治疗和与其他药物进行免疫联合治疗的研究。
关于IMbrave150研究
IMbrave150是一项在501名既往未接受过系统性治疗的不可切除的肝细胞癌患者中开展的全球性III期、多中心、开放性研究。患者按照2:1的比例随机接受泰圣奇®和安维汀®联合治疗或索拉非尼治疗。在每个21天周期的第1天经静脉注射给予泰圣奇®1200 mg;在每个21天周期的第1天经静脉注射给予安维汀®15 mg/kg。在每个21天周期的第1-21天口服给予索拉非尼,400 mg/天,每天2次。患者接受联合治疗或对照组治疗,直至出现不可接受的毒性或研究者确定无临床获益。该研究的共同主要终点为独立审查机构(IRF)根据RECIST v1.1评估的OS和PFS。次要疗效终点包括根据RECIST v1.1(研究者评估的[INV]和IRF)和HCC mRECIST(IRF)评估的总缓解率(ORR)、至疾病进展的时间(TTP)和缓解持续时间(DOR)以及患者自报结局(PRO,包括患者报告的至生活质量恶化的时间)、安全性和药代动力学。
关于肝细胞癌
肝细胞癌(HCC)是一种治疗选择有限的侵袭性癌症,是全球癌症死亡的主要原因之一。[4]每年有超过750,000人罹患肝细胞癌[4,5],大多数病例来自亚洲,其中几乎一半来自中国。[5,6]在美国,自1980年以来,肝癌病例的数量翻了三倍,而肝细胞癌更是所有癌症相关的致死原因当中上升最快的一个[5,6]。在欧洲,肝癌也出于上升趋势[7-9]。肝细胞癌主要发生于慢性肝炎(乙型或丙型)或酗酒引起的肝硬化患者中,并且通常在确诊时已是晚期。[4]不可切除肝细胞癌的预后仍然很差,系统性治疗选择很少,确诊后1年生存率不足50%。[10]
关于泰圣奇®和安维汀®联合治疗
泰圣奇®和安维汀®免疫联合疗法已获得强有力的医学证据支持。泰圣奇®和安维汀®联合治疗可增强免疫系统对抗多种癌症的潜力。除具有已知的抗血管生成作用外,安维汀®还可通过抑制血管内皮生长因子(VEGF)相关免疫抑制作用、促进T细胞肿瘤浸润以及启动和激活T细胞对肿瘤抗原的应答以进一步增强阿替利珠单抗激活免疫系统杀灭肿瘤细胞的能力。
关于泰圣奇®
泰圣奇®是一种设计用于直接与肿瘤细胞和肿瘤浸润免疫细胞上表达的PD-L1配体蛋白结合的单克隆抗体,可阻断其与PD-1和B7.1受体的相互作用。通过阻断PD-L1通路,泰圣奇®可以有效激活T细胞。泰圣奇®是一种免疫检查点抑制剂,有望作为免疫联合疗法的基础用药,与其他免疫抑制剂、靶向药物和各种化疗药联合用于治疗多种癌症。基于对免疫系统如何与肿瘤相互作用以及如何利用患者自身的免疫系统更有效地对抗癌症的深入理解,我们开发了泰圣奇®以及开展多项临床研究。
目前,泰圣奇®已在美国、欧盟和世界各国获得批准,作为单药治疗或联合靶向疗法和/或化疗用于治疗非小细胞肺癌和小细胞肺癌、特定类型转移性尿路上皮癌和PD-L1高表达的转移性三阴性乳腺癌等多种类型的癌症。在美国,泰圣奇®联合安维汀®目前已获批用于既往未接受过系统治疗的不可切除肝细胞癌患者。
关于安维汀®
安维汀®是一种通过静脉输注的处方类生物制剂,能够与VEGF蛋白特异性结合,而VEGF在肿瘤的整个生命周期中起到了血管新生和血管维护重要作用,这一过程称为血管生成。安维汀®可以通过直接结合VEGF蛋白,来阻止它与血管细胞上的受体相互作用,从而阻止肿瘤的血液供应。肿瘤血液供应被认为是肿瘤在体内生长和扩散(转移)能力的关键。
关于罗氏的癌症免疫疗法研究
50多年来,罗氏一直致力于开发创新药物,重新定义癌症的治疗。今天,我们投入比以往更多的资源,致力于研发创新的治疗方案,帮助激活患者自身的免疫系统抗击癌症。
通过设计癌症免疫周期框架,并在框架下开展肿瘤免疫分析领域的开拓性研究,罗氏正在加速推进并扩大泰圣奇®所带来的临床获益,以改变现有免疫治疗格局,同时让更广大的癌症患者获益。我们的癌症免疫疗法研究采用了综合方案来实现重建免疫力抗击肿瘤的目标,以改善患者预后。
欲了解有关罗氏癌症免疫疗法的更多信息,请访问以下链接:
http://www.roche.com/research_and_development/what_we_are_working_on/oncology/cancer-immunotherapy.htm
罗氏集团
罗氏是全球制药和诊断领域的领导者,致力于通过推动科学进步,改善人类生活。结合了制药和诊断两大业务的独特优势使罗氏集团成为个体化医疗的领导者,通过个体化医疗为每一位患者提供最具针对性的治疗方案。
作为全球领先的生物技术公司之一,罗氏在抗肿瘤、免疫、抗感染、眼科和中枢神经系统领域拥有一流的差异化药物。罗氏在全球体外诊断和基于组织的肿瘤诊断领域享有领导地位,同时也是糖尿病管理领域的先驱者。
自1896年成立以来,罗氏始终致力于不断探索更好的疾病预防、诊断和治疗方案,持续为社会做出贡献。同时,公司不遗余力地与有关的利益相关方开展合作,提升患者对于创新药物的可及性。
在世界卫生组织基本药物目录中,有30个罗氏开发的药品,包括用以挽救生命的抗生素、抗疟药和抗肿瘤药物。罗氏连续十年位列道琼斯指数(DJSI)制药、生物技术和生命科学领域可持续发展的全球领导者。
罗氏总部位于瑞士巴塞尔,业务遍及全球150多个国家。2018年,罗氏全球员工超过94,000名,研发投资112亿美元,总销售额达 577 亿美元。美国基因泰克公司(Genentech)是罗氏集团的全资子公司。此外,罗氏也是日本中外制药株式会社(Chugai)的控股方。
更多关于罗氏集团的信息,请登陆罗氏全球网站www.roche.com。
参考文献:
[1] https://www.nejm.org/doi/full/10.1056/NEJMoa1915745
[2] Food and Drug Administration. Project Orbis. [Internet; cited 2020 Mar] Available from: https://www.fda.gov/about-fda/oncology-center-excellence/project-orbis.
[3]Qin S, et al. Liver Cancer Summit 2020; OP02-03.
[4] Llovet JM et al. Hepatocellular carcinoma. Nat Rev Dis Primers. 2016;2:16018.
[5] World Health Organisation: Globocan 2018 – Liver cancer factsheet. [Internet; cited 2020 Mar] Available from: http://gco.iarc.fr/today/data/factsheets/cancers/11-Liver-fact-sheet.pdf.
[6] World Health Organisation: Globocan 2018 – China factsheet. [Internet; cited 2020 Mar] Available from: http://gco.iarc.fr/today/data/factsheets/populations/160-china-fact-sheets.pdf.
[7] American Cancer Society: Key statistics about liver cancer. [Internet; cited 2020 Mar] Available from: https://www.cancer.org/cancer/liver-cancer/about/what-is-key-statistics.html.
[8] Rawla P et al. Update in global trends and aetiology of hepatocellular carcinoma. Contemp Oncol (Pozn). 2018;22(3):141-150.
[9] Pimpin L et al. Burden of liver disease in Europe: Epidemiology and analysis of risk factors to identify prevention policies. J Hepatol. 2018;69(3):718-735.
[10] Giannini EG et al. Prognosis of untreated hepatocellular carcinoma. Hepatology. 2015;61(1):184-190.


















评论