“胃来可期”丨多组学在胃癌精准诊疗中的研究进展

Highlights:
- 胃癌精准筛查 - 低成本效益评估胃癌风险
- 胃癌分子分型 - 多维度揭示疾病复杂性
- 胃癌MRD监测 - 精准筛选胃癌术后高复发风险人群
- 胃癌免疫治疗 - TME可精准预测免疫疗效
- 胃癌靶点挖掘 - 深度挖掘弥漫型胃癌潜在药物靶标
胃癌是世界范围内最常见的癌症之一。胃癌在我国的发病率及死亡率均排名第三,疾病负担十分严峻。据统计,中国2019年胃癌新发病例数占全球总数48%,死亡病例数占全球总数44%[1]。
近年来,随着分子生物学技术的发展和各种新兴组学检测技术的涌现,从单组学到依赖于多检测平台的多组学,均在探索相关的生物学标志物,为胃癌的精准诊疗提供了重要证据[2]。
多组学是一种联合基因组、转录组及蛋白组等多维度角度的分析方法,在肿瘤治疗、诊断及监测中具有重要作用。
今天,小编为大家详细分享多组学在胃癌不同临床场景中的应用。
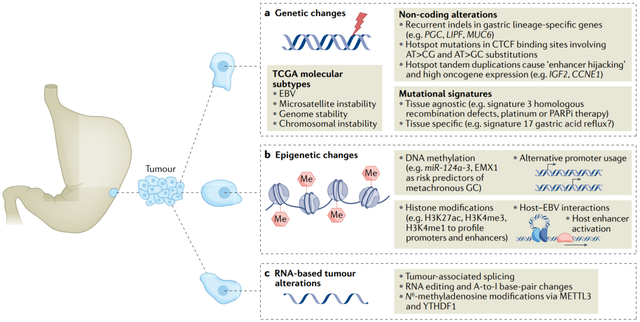
▲ 图1:基于多组学胃癌分子探索
多组学研究与进展
- 精准筛查
在胃癌发病率不高的国家或地区,对所有人进行内镜筛查则成本过高。因此,可考虑使用替代的预筛查平台来识别高胃癌风险的个体,以及那些可能从更频繁的内窥镜检查中受益的个体。
新加坡国立大学[3]开发血清12-miRNA生物标志物panel并在超过5000名个体中进行验证,结果显示血液miRNA检测比现有的基于血液的GC诊断生物标志物(CEA,CA19-9)更准确。除了miRNA外还可通过测量ctDNA中甲基化水平进行早期筛查,特异性为95%[4]。
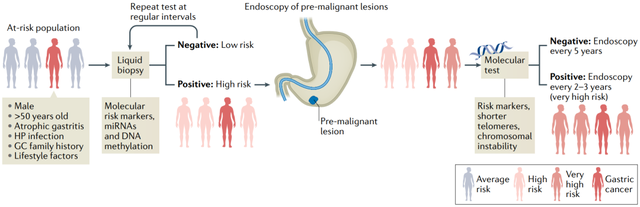
▲ 图2:胃癌基于多组学精准预防筛查策略
多组学研究与进展
- 分子分型
胃癌是高度异质性癌种且发生的分子机制复杂,分子分型方法有利于帮助临床制定个体化治疗方案和预测预后。
胃癌较认可分子分型主要为TCGA分型和ACRG分型。
TCGA分型[5]是对295例胃癌患者组织和血液标本进行体细胞拷贝数分析、全外显子测序分析、DNA甲基化分析、mRNA测序、microRNA测序、反相蛋白组分析(RPPA),通过对数据的整合分析, 最终将胃癌分为四个亚型:EBV感染型、微卫星不稳定型(MSI)、基因组稳定型(GS)和染色体不稳定型(CIN)。
ACRG分型[6]分析了300例胃癌组织,结合基因组、转录组和免疫组化将胃癌分为四个亚型:微卫星不稳定(MSI)型、上皮间质转化(EMT)型、微卫星稳定(MSS)/p53+型和微卫星稳定(MSS)/p53-型。TCGA和ACRG分型进行比较,既有重叠又有很大不同(见图3)。

▲ 图3:TCGA分型和ACRG分型特征
多组学研究与进展
- MRD监测复发及预后
循环肿瘤DNA(ctDNA)是由肿瘤细胞释放到血液中的DNA,含有与原始肿瘤细胞相同的基因突变,也是重要的生物学标志物之一。现有的研究表明,ctDNA可在胃癌的新辅助治疗,免疫治疗和动态监测上均发挥重要作用。
788例IB-IVA胃癌研究中[7],手术后可检测到肿瘤特异性突变的患者中位无事件生存期(EFS)明显缩短,疾病复发风险增加21.8倍(图4)。更多胃癌ctDNA研究可参考往期推文(ctDNA在胃癌围手术期和晚期治疗中的应用研究)
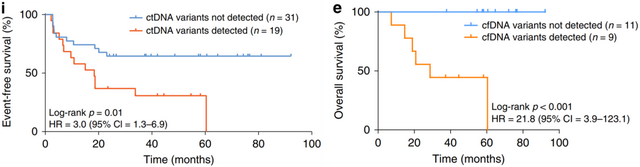
▲ 图4:ctDNA与EFS和OS的关系
多组学研究与进展
- 预测晚期免疫疗效
免疫检查点阻断剂(ICB)在少数转移性胃癌患者中持续有效,但ICB应答的决定性生物标志物尚不清楚。国内一研究机构[8]从肿瘤微环境(TME)入手,基于RNASEQ数据,开发生信分析流程对其量化,结果发现TME值(TMEscore)可预测胃癌ICB疗效,在预测性能上优于其他几类免疫标志物。不仅如此,TMEscore还可以预测免疫单药或者免疫联合的疗效。目前的研究强调了TMEscore是对晚期转移胃癌患者很有前景的预测价值。在胃癌多组学数据中探索TME可能为精确免疫治疗提供动力。
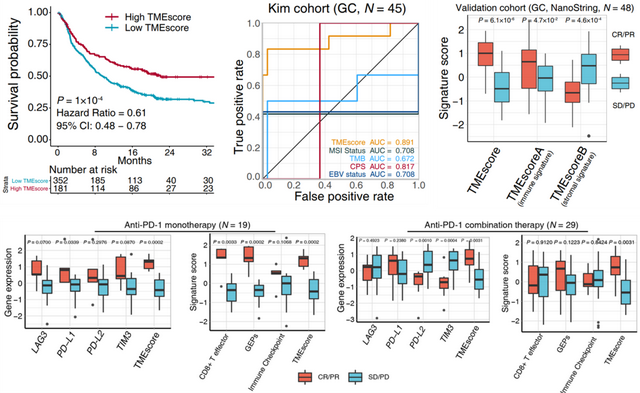
▲ 图5:TME预测免疫疗效
多组学研究与进展
- 挖掘潜在新靶点
2018年发表在Nature Communications上的一项研究[9]结合蛋白质组学和基因组学针对弥漫型胃癌(DGC)重新定义了细胞周期、EMT和免疫过程富集三种蛋白质组亚型:(PX1-3)。PX1和PX2的细胞周期失调更突出,PX2具有额外的EMT过程。PX3富含免疫反应蛋白,存活率最差,对化学疗法不敏感。根据蛋白质组学数据的特点来提名候选药物,筛选出23个与预后相关的胃癌候选蛋白药物靶标。
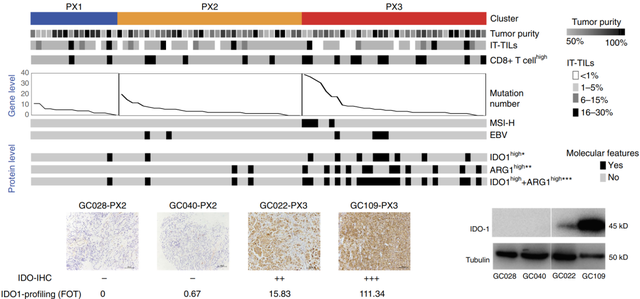
▲ 图6:三种蛋白质组亚型PX1-3特征
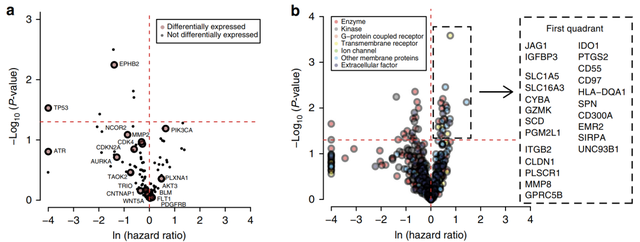
▲ 图7:提名DGC的潜在药物蛋白
小结:
- 多组学分析在胃癌的临床管理中发挥着越来越重要的角色。
- 从筛查、分子分型、预后检测到免疫治疗,为胃癌的诊疗提供新的见解。
- 基于多组学的生物标志物在实际临床中的应用还有一段路要走,还需要更多的前瞻性的验证为精准诊疗证据的收集添砖加瓦。
领星多组学检测:
领星提供临床全外显子组测序、终身随访、定制化循环肿瘤DNA监测及海外资源对接等世界一流的临床决策支持服务和精准医疗解决方案,致力于通过基因检测技术与国际医疗资源为国内肿瘤患者创造切实的临床获益。
参考文献:
1. He Y, Wang Y, Luan F, Yu Z, Feng H, Chen B, Chen W: Chinese and global burdens of gastric cancer from 1990 to 2019. Cancer Med 2021, 10(10):3461-3473.
2. Yeoh KG, Tan P: Mapping the genomic diaspora of gastric cancer. Nat Rev Cancer 2022, 22(2):71-84.
3. So JBY, Kapoor R, Zhu F, Koh C, Zhou L, Zou R, Tang YC, Goo PCK, Rha SY, Chung HC et al: Development and validation of a serum microRNA biomarker panel for detecting gastric cancer in a high-risk population. Gut 2021, 70(5):829-837.
4. Chen X, Gole J, Gore A, He Q, Lu M, Min J, Yuan Z, Yang X, Jiang Y, Zhang T et al: Non-invasive early detection of cancer four years before conventional diagnosis using a blood test. Nat Commun 2020, 11(1):3475.
5. Comprehensive molecular characterization of gastric adenocarcinoma. Nature 2014, 513(7517):202-209.
6. Cristescu R, Lee J, Nebozhyn M, Kim K-M, Ting JC, Wong SS, Liu J, Yue YG, Wang J, Yu K et al: Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med 2015, 21(5):449-456.
7. Leal A, van Grieken NCT, Palsgrove DN, Phallen J, Medina JE, Hruban C, Broeckaert MAM, Anagnostou V, Adleff V, Bruhm DC et al: White blood cell and cell-free DNA analyses for detection of residual disease in gastric cancer. Nat Commun 2020, 11(1):525.
8. Zeng D, Wu J, Luo H, Li Y, Xiao J, Peng J, Ye Z, Zhou R, Yu Y, Wang G et al: Tumor microenvironment evaluation promotes precise checkpoint immunotherapy of advanced gastric cancer. J Immunother Cancer 2021, 9(8).
9. Ge S, Xia X, Ding C, Zhen B, Zhou Q, Feng J, Yuan J, Chen R, Li Y, Ge Z et al: A proteomic landscape of diffuse-type gastric cancer. Nat Commun 2018, 9(1):1012.
声明:本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。




















评论