每周医药看点(2.22~2.28)

医药 · 看点
《已上市中药变更事项及申报资料要求》发布,妇产科用米索前列醇片说明书修订……2月22日~2月28日,医药行业的这些事情值得关注。
行业 · 政策动态
1.国家药监局发布《已上市中药变更事项及申报资料要求》,细化已上市中药变更事项,明确申报资料要求,并对变更适用人群范围、变更用法用量、替代或减去国家药品标准或药品注册标准处方中毒性药味或处于濒危状态的药味、变更药品说明书中安全性等内容这4项变更事项进行说明,明确相关技术要求,自2月24日起实施。
2.国家药监局发布第三十八批仿制药参比制剂目录,涉及复方倍他米松注射液等药品。
3.国家药监局决定对妇产科用米索前列醇片说明书进行修订,本品的上市许可持有人应按照说明书修订要求,提出修订说明书的补充申请,于5月24日前报国家药监局药审中心(CDE)或省级药品监管部门备案。
4.CDE发布《放射性体内诊断药物非临床研究技术指导原则》,自2月25日起施行;发布《药审中心技术审评报告公开工作规范(试行)》,自6月1日起施行;并就《基因修饰细胞治疗产品非临床研究与评价技术指导原则(试行)》征求意见稿,ICH Q5D、M9及M9问答实施建议公开征求意见。
5.国家药典委发布有关中药配方颗粒药品标准制定的通知。通知指出,在6家生产企业试点成果的基础上,已完成公示160个中药配方颗粒国家药品标准草案,近期将按程序报国家药监局审批颁布。39个中药配方颗粒国家药品标准正在审评过程中,另有246个中药配方颗粒品种已有企业正在开展标准研究。
产品研发 · 上市信息
1.国家药监局附条件批准国药集团中国生物武汉生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。该疫苗适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。
2.国家药监局附条件批准康希诺生物股份公司重组新型冠状病毒疫苗(5型腺病毒载体)注册申请。该疫苗是首家获批的国产腺病毒载体新冠病毒疫苗,适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。
3.国家药监局发布公告称,2021年1月,国家药监局共批准注册医疗器械产品117个。其中,境内第三类医疗器械产品86个,进口第三类医疗器械产品14个,进口第二类医疗器械产品16个,港澳台医疗器械产品1个。
4.国家药监局发布1期药品批准证明文件待领信息,共包括51个受理号,涉及湖北科益药业股份有限公司等企业(截至2月28日)。

5.国家药监局发布5期医疗器械批准证明文件(准产)待领信息,共包括60个受理号,涉及北京市富乐科技开发有限公司等企业(截至2月28日)。
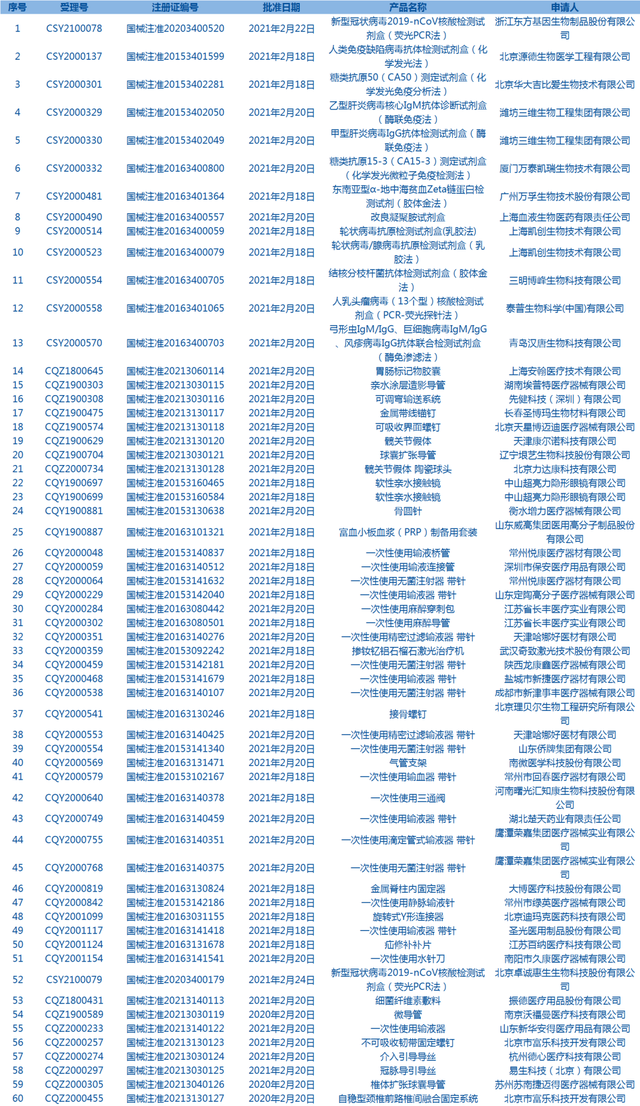
6.CDE网站公示17个仿制药一致性评价任务,涉及氯雷他定片等药品(截至2月28日)。

7.CDE承办受理34个新药上市申请,包括门冬胰岛素注射液等药品(截至2月28日)。

医药企业观察
1.重庆太极实业(集团)股份有限公司发布公告称,控股股东太极集团混改获通过,国药集团正式入主太极集团,成为太极集团实控人。
2.江苏鱼跃医疗设备股份有限公司首次通过股份回购专用证券账户以集中竞价交易方式回购公司股份964000股,占公司总股本的0.1%,最高成交价为27.86元/股,最低成交价为27.6元/股,成交金额为26809205元。
3.依生生物制药有限公司宣布完成逾1.3亿美元B轮融资,本轮融资基金将用于公司研发中心建设,推动多个疫苗产品在中国和国际多中心临床试验,以及在中国和新加坡生物疫苗生产基地的建设,加速推进产品商业化的进程。
4.三叶草生物制药有限公司宣布完成2.3亿美元C轮融资并获得超额募集。本轮融资后,三叶草生物在过去12个月的总融资额超过4亿美元。
5.中国生物制药宣布,该公司附属公司北京泰德制药股份有限公司与美国Graviton Bioscience Corporation签订了海外授权合作协议,在大中华区以外地区共同开发及商业化泰德制药自主研发的治疗纤维化创新药TDI01。
6.药明奥测宣布完成1.5亿美元B轮融资。本轮融资将用于扩张开放式创新赋能平台,加速整合诊断产品研发与全球产业布局。
药械集中采购
1.甘肃省公共资源交易局发布《关于对申请撤废药品取消中标挂网资格有关事宜的通知》,对近期41家企业53个因生产线改造、成本上涨、原料短缺、停产等原因提交撤废申请的药品取消中标挂网资格。对此次撤废品种,鼓励其他企业同功能主治药品申请阳光挂网,甘肃省对性价比优于平台已中标挂网的药品实行免备案阳光挂网。
2.云南省政府采购和出让中心发布通知明确,3月1日起,各有关单位可对2020年国家医保目录中协议期内谈判药品进行采购交易。对于协议期内医保谈判药品,有同通用名药品上市的,企业可申请直接挂网,挂网价格不得高于同规格谈判药品医保支付标准。
3.江西省医保局发布通知,启动第四批国家集采相关药品挂网采购工作。非中选药品生产企业应申报该产品的现行全国最低省级集中采购价格,并参照第四批国家集采中选价格,按照未过评药不高于过评药价格、过评药不高于原研药价格的原则,自主申报采购价格。
文/李硕整理
中国医药报社版权所有,未经许可不得转载使用。






















评论