日本新冠“神药”被曝致畸风险,盐野义制药称“不会影响上市批准决定”

华夏时报(www.chinatimes.net.cn)记者 于娜 见习记者 孙梦圆 北京报道
日本盐野义制药的新冠口服药S-217622的动物实验显示,该药或引发胎儿骨骼发育异常,存在致畸可能性,有消息称,盐野义正考虑不推荐孕妇服用这款药。
《华夏时报》记者就此问题采访盐野义制药公司,4月18日,其公共事业部Taiki Kobayashi通过邮件回复《华夏时报》记者称:“公司认为此事不会影响S-217622的上市批准决定。”今年早些时候,日本盐野义制药公司宣布完成了新冠口服药S-217622(内部研发编号)Ⅱb期临床试验分析,并已向日本厚生劳动省申请生产销售许可。
据媒体报道,根据最终试验的中期结果,在使用S-217622治疗3天后,没有检测出感染性病毒的人占比九成以上。坊间亦有消息称,这款新冠口服药的治愈率达到100%。
不过,有市场分析认为,这个被寄希望通过结构改进成为Me better新冠口服“神药”,可能存在安全性问题,离期望值甚远,而同为3CL蛋白酶抑制剂,辉瑞的Paxlovid并未曝出致畸风险。
新冠“神药”的致畸风险
盐野义制药是一家总部位于日本的全球领先的研究驱动型制药公司,已发现并开发了治疗艾滋病毒、流感和抗菌素耐药性的新药,其它重点治疗领域包括中枢神经系统/心理神经疾病、肿瘤学和疼痛。目前,盐野义已拥有三十余种获批药物,四十余种临床在研药物。
随着新冠病毒在全球范围内传播,盐野义制药因新冠口服药ensitrelvir(S-217622)被推向风口浪尖。
早在2021年7月,盐野义制药就开展了S-217622的Ⅰ期临床试验,同年9月,开展Ⅱ/Ⅲ期临床试验,S-217622的临床试验主要针对轻症/中症患者。其公告称,S-217622在对抗两股抗病毒活性与现有的变异株的使用结果相同。到2022年3月2日为止,对于轻症/中等症患者,第Ⅱ/Ⅲ期临床试验的登记以及主要评价项目已经完成,关于安全性继续进行评价。同时,现在正在进行第三阶段的病例登记。不仅在日本,在韩国、新加坡、越南等地也结束了开设临床试验网站的相关规定手续,加快了病例的累积。
盐野义制药表示,在有效性方面,与辉瑞的Paxlovid不同,S-217622能够单药使用,且安全性和便利性都要更好。也正因此,S-217622也被市场奉为下一个新冠口服“神药”。
虽然S-217622还有待更大样本、更多的临床试验数据来验证,但盐野义制药提前对S-217622进行了商业化生产,预计今年4月起能实现1000万人份/年的产能。此外,关于全球发展的合作伙伴关系,盐野义制药也正在和多家企业进行谈判。
对于此次曝出的致畸风险会否影响S-217622上市,Taiki Kobayashi通过邮件回复《华夏时报》记者称:“该非临床试验的结果已于2021年12月向厚生劳动省及独立行政法人医药品医疗器械综合机构(PMDA)报告,包含在2022年2月25日向PMDA(国家药品和医疗器械管理局)提交的批准申请资料中,这不是在这次报道时获得的新数据。我们将继续配合PMDA审查,同时推进目前正在进行的临床试验,以收集有关安全性和有效性的进一步信息。事实上,在非临床试验中,尼马曲韦和利托那韦(paxlovid的成分)均观察到胎儿生长迟缓,但尚未报告任何形态学异常。因此,从风险和效益的角度来看,孕妇都应谨慎服用。”
3CL蛋白酶抑制剂拉锯战
3CL蛋白酶(又称为主蛋白酶)是在病毒自身编码中剪切和加工RNA的蛋白酶,其抑制作用可阻止复制必需酶的形成,如RNA依赖性RNA聚合酶,从而抑制病毒复制。尽管Taiki Kobayashi表示“目前药物中3CL蛋白酶抑制剂的类别效应尚不清楚”,依然有不少药企紧跟辉瑞口服药步伐,通过合作、技术引入等形式布局3CL蛋白酶抑制剂管线研发。
长江证券研报指出,3CL 与 RpRd 已经是经过临床验证的确定性靶点,后续的新冠小分子口服药物研发聚焦于上述靶点能够相对降低临床风险。随之而来的是药企之间的“临床效率的比拼”也不容小觑,一定程度上“临床效率”才是当下新冠小分子药物研发的“生命线”。
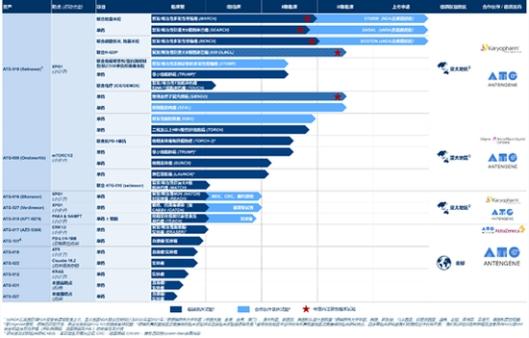
记者梳理发现,国内的3CL蛋白酶抑制剂均处于临床早期,距离真正上市还需时日。
4月19日歌礼制药发布公告称,公司新冠小分子口服药ASC11有望成为治疗新冠肺炎的有效药物。ASC11是歌礼制药完全自主研发、自主知识产权、拥有全球100%权益的,靶点为3CLpro的口服小分子候选药物。公司预计在2022年下半年提交ASC11临床试验申请,2022年底前完成在健康受试者中的I期临床试验。公告称,ASC11最新实验数据显示,ASC11的抗病毒活性(EC90)为奈玛特韦(辉瑞)的31倍,S-217622(盐野义)的120倍,PBI-0451(Pardes BioSciences)的16倍以及EDP-235(Enanta Pharmaceuticals)的7倍。
而早在2021年11月,先声药业便宣布与中科院上海药研所一同开发针对新冠病毒关键3CL蛋白酶的候选口服药物SIM0417。今年3月底,SIM0417(SSD8432)获国家药监局批准进入临床试验;4月10日,该药物已经完成所有受试者的给药。
同样是引进自中科院上海药物研究所,前沿生物的在研新药FB2001,为注射用新冠肺炎病毒(SARS-CoV-2)蛋白酶抑制剂,是基于冠状病毒主蛋白酶三维结构(3CL)设计合成的拟肽类化合物。2020年12月,FB2001的药物临床I期桥接试验申请获NMPA批准。2021年3月15日,该药物在美国启动临床I期试验。
2021年12月,广生堂子公司也通过与药明康德合作开发了3CL蛋白酶抑制剂,开发合同签署生效后至完成临床前开发工作提交Pre-IND申请的研发期限预计为四个研发季度;云顶新耀2022年1月14日公告,从新加坡获得一款3CL蛋白酶抑制剂,与A*ccelerate订立授权许可协议,引入其新冠口服药EDDC-2214,以在全球范围内利用授权产品用于治疗冠状病毒及其他疾病,并对授权技术进行改进。
全球范围内,3CL蛋白酶抑制研发进度最靠前的当属日本盐野义制药的S-217622,2月25日,其已经在日本申请上市。日本卫生部3月下旬表示已与盐野义达成协议,一旦S-217622获得批准,将考虑购买100万剂该药物。此前,盐野义制药相关负责人透露,将在美国政府的支持下,在全球范围内启动该药物的III期临床试验。
值得注意的是,作为日本第五大制药企业的盐野义制药背后关联多家中国企业,2020年3月,中国平安与盐野义制药”达成战略合作协议,盐野义制药向中国平安旗下中国平安人寿出售库存股635.6万股,交易总额为335.3亿日元(约合21.8亿人民币)。交易完成后,平安人寿合计持有盐野义制药2%的股份,成为盐野义制药第七大股东。与此同时,双方还计划在中国香港成立合资公司,该合资公司计划初期聚焦于中枢神经系统的新药疗法,将获得盐野义制药旗下两款新药在亚洲地区(除日本外)的独家代理权,该合资公司还将开展新药研发、制造及销售等多方面业务。北大医药是其中最大的受益者,据悉,北大医药目前是平安健康旗下唯一上市平台,具有全国性的销售网络,完善的原料药产线。
此外,长江健康子公司与盐野义制药公司有多年的良好合作关系,盐野义曾为公司下属上海益威实业有限公司的重要股东。公司与盐野义下属长澳药业科技集团有限公司正开展紧密合作。


















评论