生物医药双周观察

撰文|王志 编辑|LZ
生物医药二月批签发与临床动态(2021年2月8日-2021年3月11日)
一、批签发(2021年2月1日-2月28日)
13价肺炎球菌多糖结合疫苗批签发量190.17万支。其中,沃森生物获批签发49.32万支。
23价肺炎球菌多糖疫苗批签发量148.82万支。其中,北京民海生物(康泰生物全资子公司)获批签发63.22万支,沃森生物获批签发12.69万支。
A群C群脑膜炎球菌多糖结合疫苗批签发量108.36万支。其中,北京智飞绿竹(智飞生物全资子司)获批签发54.72万支,沃森生物获批签发53.64万支。
b型流感嗜血杆菌结合疫苗批签发量12.19万支,全属沃森生物。
无细胞百白破b型流感嗜血杆菌联合疫苗批签发量95.32万支,全属北京民海生物(康泰生物全资子公司)。
冻干人用狂犬病疫苗(Vero细胞)批签发量384.01万瓶。其中,成大生物获批签发103.57万瓶。
冻干人用狂犬病疫苗(人二倍体细胞)批签发量16.4万瓶,全属康华生物。
水痘减毒活疫苗批签发量244.17万瓶。其中,科兴大连(科兴生物[SVA.O]间接控股子公司)获批签发13.88万瓶;百克生物获批签发91.28万瓶。
四价流感病毒裂解疫苗批签发量60.66万瓶,全属拟上市公司金迪克。
ACYW135群脑膜炎球菌多糖疫苗批签发量60.13万瓶。其中,北京智飞绿竹(智飞生物全资子司)获批签发31.11万瓶;沃森生物获批签发29.03万瓶。
乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)批签发量9.74万盒。其中,万泰生物获批签发5.14万盒;中山生物工程(达安基因全资子公司)获批签发3962盒;华大吉比爱(华大基因控股子公司)获批签发5935盒;科华生物获批签发1.34万盒;珠海丽珠试剂(丽珠集团控股子公司)获批签发1.1万盒。
重组乙型肝炎疫苗(酿酒酵母)批签发量219.01万支,全属康泰生物。
丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)批签发量8.59万盒。其中,科华生物获批签发8636盒;华大吉比爱(华大基因控股子公司)获批签发9917盒;珠海丽珠试剂(丽珠集团控股子公司获批签发8959盒;万泰生物获批签发3.75万盒。
梅毒螺旋体抗体诊断试剂盒(酶联免疫法)批签发量10.01万盒。其中,科华生物获批签发1.73万盒,万泰生物获批签发5.2万盒;珠海丽珠试剂(丽珠集团控股子公司)获批签发1.1万盒。
人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)批签发量5.78万盒。其中,万泰生物获批签发3.93万盒;华大吉比爱(华大基因控股子公司)获批签发9985盒;科华生物获批签发8562盒。
吸附破伤风疫苗批签发量26.11万瓶,全属拟上市公司欧林生物。
肠道病毒71型灭活疫苗(Vero细胞)批签发量136.34万瓶,全属北京科兴生物(科兴生物[SVA.O]子公司)。
人类免疫缺陷病毒抗原抗体诊断试剂盒(酶联免疫法)批签发量1.28万盒,全属万泰生物。
甲型肝炎灭活疫苗(人二倍体细胞)批签发量165.92万支,全属北京科兴生物(科兴生物[SVA.O]子公司)。
人用狂犬病疫苗(Vero细胞)批签发量28.64万瓶,全属大连雅立峰(复星医药全资子公司)。
双价人乳头瘤病毒疫苗(大肠杆菌)批签发量15.23万瓶,全属厦门万泰(万泰生物全资子公司)。
A群C群脑膜炎球菌多糖疫苗批签发量130.3万瓶。其中,沃森生物获批签发60.13万瓶。
人凝血酶原复合物批签发量6576瓶,全属博雅生物。
二、临床动态(2021年2月8日-3月11日)
百奥泰在研药品司库奇尤单抗(BAT2306)注射液收到国家药监局《临床试验批准通知书》,该药物是百奥泰开发的生物类似药,其活性成分是中国仓鼠卵巢细胞表达的IgG1 kappa亚型单克隆抗体,能以高亲和力特异性地结合人白介素17A(IL-17A)和人白介素17A/F(IL-17A/F),从而抑制白介素17介导的自身免疫炎症反应。
目前,已获批上市的司库奇尤单抗药物为诺华制药的Cosentyx(商品名:可善挺)。百奥泰为首家在中国获得司库奇尤单抗生物类似药临床试验批准的公司。
贝达药业在研产品BPI-D0316胶囊取得药品注册Ⅱ期临床试验总结报告,该药物是第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。截至目前,已有奧希替尼和阿美替尼两款第三代EGFR-TKI获得批准及上市。
科伦药业控股子公司四川科伦博泰开发的创新药物 SKB337 注射液获得国家药监局临床试验通知书,该药物是公司自主研发的,具有知识产权的肿瘤免疫检查点新一代双特异抗体。未来在实体瘤和血液瘤领域,有望与公司已有管线 KL-A167 等肿瘤免疫药物形成优势互补。
截至目前,全球尚无同靶点双抗药物获批上市,公司在SKB337注射液项目上已投入研发费用约2368万元。
恒瑞医药子公司山东盛迪收到国家药监局核准签发关于HR20005凝胶的《药物临床试验批准通知书》,将于近期开展用于缓解成人静脉穿刺痛的临床试验。该药物目前已累计投入研发费用约为714万元。
目前,针对静脉留置针穿刺镇痛,国内外有贴剂、乳膏剂和无针粉末经皮注射给药制剂等多种剂型获批上市。
百奥泰终止BAT8001临床试验。截至2020年12月,该药物研发项目累计投入2.26亿元。据其披露“按照相关会计准则和公司会计政策,该项目的全部研发支出已计入相应会计期间损益。”
百奥泰终止BAT8003(即注射用重组人源化抗Trop2单克隆抗体-美登素偶联物)和BAT1306(即重组人源化抗PD-1单克隆抗体注射液)临床试验。截至2020年12月,公司BAT8003研发项目累计投入6156.5万元,BAT1306研发项目累计投入5197.45万元。
微芯生物西奥罗尼胶囊收到国家药监局签发的IND(新药临床试验申请)《受理通知书》。该药物是公司自主设计和研发的具有全球专利保护的新化学结构体,属于多靶点多通路选择性激酶抑制剂。属于小分子抗肿瘤原创新药,可选择性抑制Aurora B、CSF1R和VEGFR/PDGFR/c-Kit等多个激酶靶点。
复星医药控股子公司Novelstar收到美国FDA关于同意NS002片用于炎性关节病治疗进行临床试验的函,Novelstar拟于近期条件具备后于美国开展该新药针对上述适应症的BA(相对生物利用度)临床试验。截至2020年12月,复星医药对该新药累计研发投入折合人民币约602万元(未经审计)。
君实生物与微境生物共同投资的苏州君境生物收到国家药监局核准签发的《受理通知书》,XPO1抑制剂WJ01024片(项目代号“JS110”)的临床试验申请获得受理。JS110是核输出蛋白XPO1的小分子抑制剂,临床上拟用于治疗晚期肿瘤病人。公司拥有JS110在全球范围内的独家生产权、委托生产权及销售权。
君实生物与微境生物共同投资的苏州君境生物收到国家药监局核准签发的《受理通知书》,EGFR非常见突变抑制剂AP-L1898胶囊(项目代号“JS111”)的临床试验申请获得受理。该药物是一种有效抑制EGFR(表皮生长因子受体)非常见突变的靶向小分子抑制剂。公司拥有JS111在全球范围内的独家生产权、委托生产权及销售权。
君实生物子公司拓普艾莱近日正式获得 FDA 关于特异性抗TIGIT单克隆抗体注射液用于治疗晚期恶性肿瘤的临床试验批准,公司将于近期在美国开展临床试验。目前,国内外尚无同类靶点产品获批上市。
此前,该药物于2021年1月获得国家药监局批准。
华东医药全资子公司杭州中美华东与美国Provention Bio公司签署产品独家临床开发及商业化协议。中美华东获得Provention Bio在研产品——双特异性抗体PRV-3279两个临床适应症,在大中华区(含中国大陆,香港、澳门和台湾地区)的独家临床开发及商业化权益,以上两个适应症目前均处在研发过程中。
中美华东将向Provention Bio支付600万美元首付款,1150万美元的研发和生产支持经费,最高不超过1.72亿美元的里程碑付款,以及约定分级的、两位数的净销售额提成费。
恒瑞医药收到国家药监局核准签发的关于氟唑帕利胶囊及甲磺酸阿帕替尼片的《药物临床试验批准通知书》,并将于近期开展氟唑帕利联合阿帕替尼或氟唑帕利单药治疗转移性去势抵抗性前列腺癌的开放、多中心、Ⅱ期临床研究。
除用于铂敏感的复发性卵巢癌、输卵管癌或原发性腹膜癌治疗外,氟唑帕利胶囊单药或联合甲磺酸阿帕替尼片的多个适应症开发已处在III期临床研究阶段,另有多种联合治疗方案,包括与阿比特龙联合、与抗PD-L1抗体SHR-1316联合、以及与替莫唑胺联合治疗多种实体肿瘤已处于临床开发阶段。
广生堂与泰格医药签订了《技术服务合同》,委托后者为公司评价GST-HG141片在慢性乙型肝炎患者中多中心、随机、双盲、 安慰剂对照的多剂量、多次给药的耐受性、药代动力学和药效学Ib期临床试验提供服务。公司将借助泰格医药的平台优势,加快推进GST-HG141的临床研究进度。
该药物是全新靶点的抗乙肝病毒一类新药,是乙肝核心蛋白抑制剂,可以抑制 HBV(乙肝病毒)衣壳的脱壳与组装。
上海医药合资公司上药博康生物开发的 Prolgolimab 注射液收到国家药监局核准签发的《药物临床试验批准通知书》,该药物是一种以单克隆IgG1抗体为骨架的全人抗PD-1单抗注射液,由上药博康于2019年9月License-in。
经上药博康与国家药监局药品审评中心沟通,基于该项目已在俄罗斯上市,国家药监局同意按照已提交的方案开展III期临床试验。
恒瑞医药氟唑帕利胶囊已获得美国 FDA 国际多中心临床试验资格,并将于近期开展相关临床试验。该药物已于2020年12月11日获得国家药监局批准用于既往经过二线及以上化疗的伴有胚系BRCA突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。
目前,该临床试验已在中国、美国获批开展,后续计划在澳洲、欧洲、韩国、中国台湾等国家及地区申请开展国际多中心临床试验。
泽璟制药自主研发产品盐酸杰克替尼片治疗中、高危骨髓纤维化的II期临床研究取得成功结果。结果显示,盐酸杰克替尼片不仅可以显著缩小骨髓纤维化患者的脾脏体积、减轻患者的体质性症状,还可以改善贫血,减少输血依赖,改善患者的生存质量。
该药物用于治疗骨髓纤维化的研究获得国家“重大新药创制”科技重大专项立项支持。目前已在国内上市治疗中、高危骨髓纤维化的同类作用机制药物仅有进口药物芦可替尼。
浙江医药子公司浙江新码生物收到国家药监局核准签发的注射用重组人源化抗HER2单抗-AS269偶联物(ARX788)《药物临床试验批准通知书》,同意开展用于胃癌和胃食管连接部腺癌治疗的II/III期临床试验。
该药物是公司于2013年6月14日与美国Ambrx公司签署《合作开发和许可协议》合作研发的新一代单克隆抗体偶联药物,用于治疗HER2阳性晚期乳腺癌和胃癌等,属于创新生物技术药物。
截至2020年12月31日,公司ARX788项目已累计投入研发费用3.45亿元。
君实生物收到国家药监局核准签发的《受理通知书》,PD-1/ TGF-β 双功能融合蛋白JS201注射液(项目代号“JS201”)的临床试验申请获得受理。该药物可有效阻断PD-1/PD-L1和TGF-β免疫抑制通路,改善肿瘤微环境中的免疫调节作用,从而促进人体免疫系统对于肿瘤细胞的杀伤作用,有效增强免疫应答,减少免疫逃逸及耐药性的发生 。目前,国内外尚无同类靶点产品获批上市。
贝达药业收到国家药监局签发的《药物临床试验批准通知书》,公司申报的BPI-361175片用于治疗携带EGFR C797S突变及其他EGFR相关突变的晚期非小细胞肺癌等实体瘤的药品临床试验申请已取得国家药监局批准。
该药物是一个由贝达药业自主研发的拥有完全自主知识产权的新分子实体化合物,是一种新型强效、选择性的第四代表皮生长因子受体口服小分子抑制剂。
恒瑞医药子公司苏州盛迪亚近日收到国家药监局核准签发的关于苹果酸法米替尼胶囊及SHR-1701注射液的《药物临床试验批准通知书》,将于近期开展 SHR-1701联合或不联合苹果酸法米替尼治疗既往系统化疗失败的广泛期小细胞肺癌开放、多中心Ⅱ期研究。
苹果酸法米替尼胶囊是公司创新研发的小分子多靶点酪氨酸激酶抑制剂,目前三款多靶点抑制剂均已在国内获批上市。截至目前,苹果酸法米替尼相关项目累计已投入研发费用约为13936万元。
SHR-1701适应症以晚期恶性肿瘤为主,国内外尚无同类靶点产品获批上市。截至目前,相关项目累计已投入研发费用约为15349万元。
三生国健自主研发的重组抗 VEGF 人源化单克隆抗体视网膜静脉阻塞(RVO)项目 II 期临床实验首例受试者已顺利完成入组。该药物目前正在分别推进 4 个适应症的临床实验,分别为:视网膜静脉阻塞(RVO)、年龄相关性黄斑变性(AMD)、糖尿病黄斑水肿(DME)、病理性近视的脉络膜新生血管导致的视力损害(pmCNV)。截止到2020年12月31日,已累计研发投入金额为1.38亿元。
泽璟制药启动注射用重组人促甲状腺激素Ⅲ期临床试验,该药物是是公司自主研发的生物大分子药物,属于3类治疗用生物制品。
贝达药业申报的BPI-21668片用于治疗晚期实体瘤的药品临床试验申请已获得国家药监局批准,该药物是一个由贝达药业自主研发的拥有完全自主知识产权的新分子实体化合物,是一种新型强效、高选择性的磷脂酰肌醇3-激酶α 口服小分子抑制剂 ,拟用于基因突变的晚期实体瘤的治疗。
目前,全球仅有一款PI3Kα选择性抑制剂Alpelisib(诺华开发)获批用于携带PIK3CA突变的HR+/HER2-乳腺癌治疗,中国区域内尚无PI3Kα选择性抑制剂上市。BPI-21668属于“境内外均未上市的创新药”,其注册分类为化学药品1类。
长春高新控股子公司百克生物鼻喷流感减毒活疫苗(液体剂型)获得药物临床试验批准通知书,同意按照提交的方案开展预防本株病毒引起的流行性感冒的临床试验。
天坛生物控股子公司成都蓉生获得国家药监局签发的《药物临床试验批准通知书》,同意开展“皮下注射人免疫球蛋白(注射液)”临床试验。
德展健康子公司北京东方略的美国合作方 Inovio 公司宣布了其与东方略联合研发的一项DNA治疗药物VGX-3100与器械CELLECTRATM 5PSP联合治疗HPV-16/18相关宫颈高度鳞状上皮内病变(HSIL)的首个III期临床试验(REVEAL 1)的积极结果,在全部可评估受试者中,达到临床疗效的主要终点和所有次要终点。
VGX-3100是东方略与Inovio公司在DNA免疫治疗领域的重点合作开发项目,用于治疗由人类乳头状瘤病毒(HPV)导致的癌前病变,东方略拥有产品在大中华区(中国大陆、香港、澳门、台湾)开发、生产和商业化的独家权利,目前已经取得中国CFDA的三期临床试验批件,正在中国同步开展三期临床试验。
VGX-3100一旦获批上市,将是全球首个被开发用于治疗HPV相关癌前病变(宫颈癌前病变、肛门癌前病变、外阴癌前病变等)的非手术治疗手段,也是全球第一个DNA 药物。在全球范围内,这三个适应症目前均无手术之外的治疗方式,药物治疗方面暂为空白。
君实生物JS103注射液的临床试验申请获得国家药监局核准签发的《受理通知书》,该药物公司自主研发的聚乙二醇化尿酸酶衍生物,主要用于高尿酸血症伴或不伴有痛风的治疗,其可通过催化尿酸氧化成溶解度显著高于尿酸的尿囊素,从而达到降低血尿酸的作用。
华东医药全资子公司中美华东收到国家药监局核准签发的《受理通知书》,由中美华东和美国MediBeacon公司申报的1类新药MB-102注射液(Relmapirazin)临床试验申请获得受理。
该药物是一种用于测量肾小球滤过率的荧光示踪剂,通过MediBeacon全球首创的TGFR动态监测系统无创监测MB-102产生的荧光信号随时间的改变,可实时、动态反映GFR,供临床医生对患者的肾功能进行即时评估及诊断。
MediBeacon目前已在美国完成了探索性Ⅰ期和Ⅱ期临床试验,预计2021年下半年启动关键性III期国际多中心临床试验,2022年在美国递交MediBeacon® TGFR动态监测系统的上市申请。
2019年7月13日,公司与MediBeacon达成股权投资及独家商业化协议,获得MediBeacon拥有全部产品(含后续开发新产品)在中国大陆、香港、台湾、新加坡、马来西亚在内的25个亚洲国家或地区的独家商业化权利。
智飞生物全资子公司北京智飞绿竹研发的组份百白破疫苗近日在湖南常德石门县疾病预防控制中心开始 I 期临床试验。百白破疫苗是针对百日咳、白喉、破伤风三种疾病的联合疫苗。
截至目前,国产无细胞百白破疫苗为采用共纯化技术制备。智飞绿竹研制的组份百白破疫苗是新一代的无细胞百白破疫苗,采用单独纯化的百日咳有效组份配制出的质量均一疫苗产品,可替代目前免疫规划疫苗中的百白破疫苗。
恒瑞医药近日向 FDA 提交了注射用卡瑞利珠单抗联合苹果酸法米替尼胶囊治疗晚期实体瘤的Ⅱ期临床试验申请并获受理。
注射用卡瑞利珠单抗是人源化抗PD-1单克隆抗体,可与人PD-1受体结合并阻断PD-1/PD-L1通路,恢复机体的抗肿瘤免疫力,从而形成癌症免疫治疗基础。截至目前,注射用卡瑞利珠单抗相关项目累计已投入研发费用约为141037万元。
苹果酸法米替尼胶囊是公司创新研发的小分子多靶点酪氨酸激酶抑制剂。截至目前,苹果酸法米替尼相关项目累计已投入研发费用约为13936万元。
海南海药控股子公司海口市制药厂近日获得国家药监局核准签发的化学药品“阿莫西林胶囊”的《药品补充申请批准通知书》。经审查,本品通过仿制药质量和疗效一致性评价。该药物主要用于敏感菌(不产β内酰胺酶菌株)所致的成人与儿童的感染性疾病的治疗。
华海药业向美国 FDA 申报的丙酸氯倍他索外用溶液的新药简略申请已获得批准,该药物主要用于以治疗某些皮肤状况引起的瘙痒,发红和肿胀等。
君实生物收到国家药监局核准签发的《药品注册证书》,特瑞普利单抗用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗的新适应症上市申请获得附条件批准。鼻咽癌是一种发生于鼻咽部黏膜上皮的恶性肿瘤,是常见的头颈部恶性肿瘤之一。
百奥泰近日收到国家药监局核准签发的关于阿达木单抗注射液(商品名称:格乐立®)《药品补充申请批准通知书》。该药品获批新增适应症“儿童斑块状银屑病”。
格乐立®为公司研发的阿达木单抗生物类似药,是由CHO细胞表达的重组全人源单克隆抗体。目前,格乐立®获批适应症为强直性脊柱炎、类风湿关节炎、银屑病、克罗恩病、葡萄膜炎和儿童斑块状银屑病。
普洛药业盐酸美金刚片获得国家药监局核准签发的《药品注册批件》,该药物是用于治疗中重度阿尔茨海默症的药物,属于2020年版国家医保乙类药物。
康华生物人二倍体狂犬病疫苗在原生产线基础上增加原液生产车间“病毒性疫苗二车间”,获得四川省药监局《药品补充申请批件》,下一步需要通过药品生产质量管理规范符合性检查并完成《药品生产许可证》许可事项变更后,方可投产。
乐普医疗全资子公司乐普药业近日收到国家药监局核准签发的《药品注册批件》,替格瑞洛片获得产品注册批件,“单硝酸异山梨酯缓释片”通过了仿制药质量和疗效一致性评价。
替格瑞洛(Ticagrelor)是一种环戊基三唑嘧啶类新型口服抗血小板药物。用于急性冠脉综合征患者,包括接受药物治疗和经皮冠状动脉介入(PCI)治疗的患者,降低血栓性心血管事件的发生率。
单硝酸异山梨酯为硝酸异山梨酯的主要活性代谢产物,主要用于治疗冠心病的长期治疗,心绞痛(包括心肌梗塞后)的长期治疗和预防;与洋地黄及(或)利尿剂合用治疗慢性充血性心力衰竭。
灵康药业全资子公司美大制药收到国家药监局核准签发的注射用头孢唑肟钠《药品注册批件》。该药物适应症为敏感菌所致的下呼吸道感染、尿路感染、腹腔感染、盆腔感染、败血症、皮肤软组织感染、骨和关节感染、肺炎链球菌或流感嗜血杆菌所致脑膜炎和单纯性淋病。
人福医药控股子公司宜昌人福收到 FDA 关于琥珀酸美托洛尔缓释片的批准文号。琥珀酸美托洛尔缓释片用于治疗高血压、心绞痛以及伴有左心室收缩功能异常的症状稳定的慢性心力衰竭。宜昌人福于2019年提交琥珀酸美托洛尔缓释片的ANDA申请,累计研发投入约为190万美元。
济川药业全资子公司东科制药收到国家药监局核准签发的宫瘤清片药品补充申请批准通知书。该药物是《国家基本医疗保险、工伤保险和生育保险药品目录(2020年版)》甲类品种,主治活血逐瘀,消癥破积,用于瘀血内停所致的妇女癥瘕,症见小腹胀痛、经色紫黯有块、经行不爽;子宫肌瘤。
昊海生科研制的盐酸莫西沙星滴眼液用于治疗细菌性结膜炎的上市注册申请获国家药监局批准,该药物为公司自主研发的化学药品,用于细菌性结膜炎的治疗。昊海生科预计将成为国内首个完成本产品仿制药申请注册的国产生产商。
三、资金流向
2月1日-3月11日,医药生物(申万)板块(801150)指数跌幅7.42%。其中,14天上涨,10天收阴,成交量1.92万亿元。单看2月份,跌幅1.61%,指数先是由2月1日的12152.91点整体向上涨至2月18日的最高点13546.62点,随后进入整体向下的调整期。
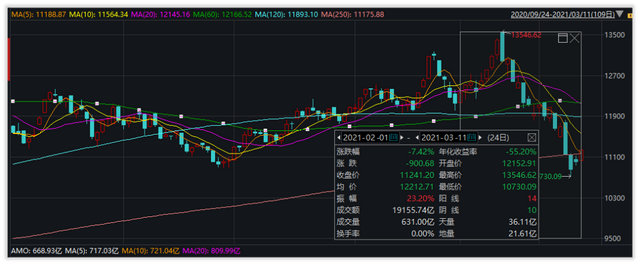
数据来源:Wind
资金流向方面,近5个交易日,主力资金净流出23.48亿元。近20个交易日,主力资金净流出54.78亿元。近60个交易日,主力资金净流入71.89亿元。
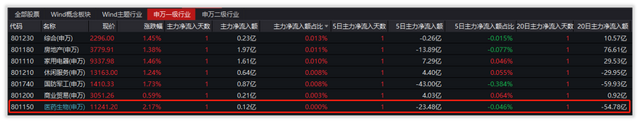
数据来源:Wind
睿蓝财讯出品
文章仅供参考 市场有风险 投资需谨慎
来源:蓝筹企业评论(ID:bluechip808)



















评论