药研社资讯:武汉新型冠状病毒现首例海外患者,55家药企年报预告
「本文共:14条资讯,阅读时长约:3分钟 」
01今日头条
艾伯维维奈克拉片3项上市申请获受理。艾伯维重磅抗癌药维奈克拉片(venetoclax)的3项上市申请获国家药监局受理。维奈克拉是由艾伯维和基因泰克共同研发的一款的“first-in-class”选择性B细胞淋巴瘤因子-2(BCL-2)抑制剂, 曾获FDA授予多项突破性疗法认定, 是FDA批准的首个BCL-2抑制剂, 用于治疗白血病。在中国,该药物目前仍有3项临床正在开展中,适应症分别为急性髓系白血病、初治急性髓系白血病以及伴17p缺失的复发性或难治性慢性淋巴细胞白血病。此外,该药物拟用于治疗多发性骨髓瘤(MM)的临床申请刚刚获得国家药监局临床批准。

02医药热点
1.跨省异地就医直接结算人次超424万。国家医保局发布数据显示,截至2019年12月底,跨省异地就医直接结算医疗机构达到27608家,二级及以下定点医疗机构24720家,分别比2018年增加12197家、11917家;累计结算人次424.6万,医疗费用1016.2亿元,基金支付599.7亿元,基金支付比例59.0%;国家平台有效备案人数539.3万。在发布年终跨省异地就医直接结算的数据的同时,国家医保局还宣布正式启用官方标志及徽标。
2.武汉新型冠状病毒首例海外患者出现。世卫组织于1月13日表示,一名从中国武汉前往泰国旅游的游客1月8日在泰国被确诊为感染了新型冠状病毒,并于当天被送往泰国的医院接受治疗。这也是首例在中国以外地区发现的感染病例。患者目前正在隔离病房接受治疗,现已没有发烧和其他呼吸道症状,预计几天后就可返回中国。泰国卫生部尚不清楚该名患者是否去过武汉华南海鲜市场。机上16名密切接触者正在接受观察,目前并未发现感染。
3.55家医药企业公布年报业绩预告。截止日前,A股已有55家医药企业发布了2019年年报业绩预告。经同花顺统计,有33家企业业绩预增。在这些业绩预增企业中,业绩预增幅度在100%以上的有6家,分别为人福医药、泰合健康、ST冠福、沃华医药、信邦制药及光正集团。其中光正集团预告净利润增幅最大,为273.75%-206.92%;业绩预增幅度在50%-100%的有10家,业绩预增幅度在0-50%的有13家,有4家企业未披露增幅范围。有8家企业预告亏损,且其净利润同比下滑率均超过了150%。其中,创新医疗首亏的净利润同比下滑最高,达-3132.63%至-3806.55%。
03国内药讯
1.科伦药业奥硝唑片通过仿制药一致性评价。科伦药业奥硝唑片获国家药监局核发的《药品补充申请批件》,该药通过仿制药一致性评价。奥硝唑是继甲硝唑、替硝唑之后的第三代硝基咪唑类药物,临床广泛用于治疗由厌氧菌、阿米巴原虫、贾滴虫、毛滴虫等感染引起的多种疾病,目前已被《抗菌药物临床应用指导原则(2015年版)》和《胆道外科抗菌药物规范化应用专家共识(2019版)》等国内权威指南或专家共识广泛推荐使用。奥硝唑片为国家医保乙类药物,2018年中国销售额2.69亿元。
2.鲁抗医药旗下蒙脱石散通过一致性评价。鲁抗医药控股子公司鲁抗医药集团赛特公司的蒙脱石散获国家药监局核发的《药品补充申请批件》,该药通过仿制药一致性评价。蒙脱石散主要用于成人及儿童急、慢性腹泻,食道、胃、十二指肠疾病引起的相关疼痛症状的辅助治疗,是国内感染性腹泻临床指南的推荐用药。2019年1月份到9月份,该药在国内的医疗机构终端和零售终端销售额约为7亿元人民币。目前国内共有39个蒙脱石散生产批文,维奥制药、扬子江药业等13个公司通过了一致性评价审批。
3.嘉逸医药有望拿下盐酸西那卡塞首仿。嘉逸医药4类仿制药盐酸西那卡塞片的上市申请审评状态处于"在审评审批中",嘉逸医药是该品种唯一一家被纳入优先审评的企业,有望率先拿下西那卡塞首仿。盐酸西那卡塞是一款口服的钙敏感受体激动剂。该药由NPS Pharmaceuticals研发, 最早于2004年3月由安进开发在美国获批上市,商品名Sensipar,目前该原研药已获批进口中国。盐酸西那卡塞在美国获批的适应症包括接受透析慢性肾病患者的继发性甲状旁腺功能亢进(SHPT)、甲状旁腺腺癌患者的高钙血症和原发性甲状旁腺功能亢进患者的高钙血症。
4.默克重磅在研新药M7824临床申请获受理。默克在研新药M7824临床申请获国家药监局受理。M7824是一种新型的双功能融合蛋白,由靶向PD-L1蛋白的IgG1单克隆抗体和人类转化生长因子-β受体II型融合而成。目前,默克就M7824已启动了多项临床试验,在研适应症覆盖了非小细胞肺癌、结直肠癌、食道癌、胃癌、复发性呼吸道乳头病、胆囊癌/胆管癌等多种恶性肿瘤。在中国市场,M7824正在开展的临床研究有两项:一项是M7824单药治疗局部晚期或转移性胆管癌的II期临床(CTR20191364),另外一项是M7824和派姆单抗一线治疗PD-L1表达阳性晚期非小细胞肺癌的研究(CTR20190305)。
04国际药讯
1.奥拉帕利组合疗法获优先审评资格。阿斯利康/默沙东奥拉帕利(olaparib,Lynparza)的补充新药申请已获FDA受理,并获授予优先审评资格,联合贝伐珠单抗(bevacizumab),用于对含铂化疗药完全或部分应答的晚期卵巢癌患者的一线维持治疗。一项Ⅲ期研究PAOLA-1显示,与贝伐珠单抗相比,Lynparza联合贝伐珠单抗可将疾病进展或死亡的风险降低41%(HR=0.59,p<0.0001),并将患者的中位PFS从16.6个月延长至22.1个月;Lynparza联合治疗组有46%的患者在治疗的两年间没有出现疾病进展,bevacizumab组这一数值为28%。如果获批,这将是Lynparza在美国获批治疗卵巢癌的第4个适应症。
2.Adaptimmune公司TCR-T疗法对4例实体瘤患者有效。Adaptimmune Therapeutics公布其TCR-T疗法对实体瘤患者的积极早期数据。I期临床ADP-A2AFP研究有1例肝细胞患者实现了确证后的部分应答,目标病灶缩小了100%;I期ADP-A2M4研究有1例直肠黏膜黑色素瘤患者实现了经确证的部分应答,目标病灶缩小了42%;扩展研究阶段的1例头颈癌患者实现了未经确证的部分应答,目标病灶缩小了36%;I期SURPASS研究有1例转移性胃食管连接部癌患者实现了未经确证的部分应答,目标病灶缩小了42%。此次公布的数据则进一步证明了Adaptimmune公司针对多种实体瘤的SPEAR T-cell技术平台的巨大潜力。
3.阿斯利康鱼油产品心血管预后III期临床失败。阿斯利康将终止评估Epanova作为他汀类药物附加疗法用于混合型血脂异常(MDL)患者降低心血管风险的大规模III期STRENGTH研究。该项决定基于独立数据监测委员会的建议,委员会认为这项研究成功的可能性很低。Epanova是阿斯利康在2013年7月耗资4.43亿美元收购Omthera公司获得,2014年5月,Epanova已获FDA批准,用于严重高甘油三脂血症(甘油三酯水平≥500mg/dL)成人患者,降低甘油三酯水平。
4.BI收购临床前抗IL-11疗法。勃林格殷格翰(BI)收购Enleofen公司临床前白介素-11(IL-11)平台的全球独占权,以开发各种纤维炎症性疾病的first-in-class疗法。据悉,BI将全权负责被许可的治疗方案,包括临床、注册和商业推广。Enleofen在每款产品前期、成功开发及商业化的里程碑阶段可能会收到超过10亿美元。Enleofen是一家从健保集团(SingHealth)新加坡国立心脏中心(NHCS)和杜克-NUS医学院分拆出来的公司,隶属于新加坡SingHealth杜克-NUS学术医学中心(AMC)。2017年成立时,AMC出让了一系列专利权和诸多抗体产品给Enleofen。此后,Enleofen公司搭建了广泛的抗IL-11抗体平台,并将其药物开发项目推向临床。
5.Incyte和MorphoSys公司联手开发创新CD19抗体。Incyte和MorphoSys公司就MorphoSys 的创新CD19抗体tafasitamab达成一项全球性研发和推广合作协议。tafasitamab抗体已获FDA授予的突破性疗法认定,与来那度胺(lenalidomide)联用,治疗复发/难治性弥漫性大B细胞淋巴瘤(R/R DLBCL)患者。目前,MorphoSys已向FDA递交了tafasitamab联合来那度胺治疗R/R DLBCL患者的上市申请,FDA预计在今年年中给出答复。根据协议,MorphoSys公司将获得7.5亿美元前期付款,Incyte公司将对MorphoSys公司进行1.5亿美元的股权投资。MorphoSys还可能获得高达11亿美元的里程碑付款以及tafasitamab在美国以外的销售额分成。
6.渤健7亿美元收购CNS创新疗法。渤健与辉瑞达成协议,收购辉瑞一款能够穿越血脑屏障进入中枢神经系统的酪蛋白激酶1(CK1)小分子抑制剂PF-0251749。PF-05251749已在Ⅰ期临床中表现出可以接受的安全性和作用机制的概念证明。渤健计划在第四季度启动Ⅰb期临床,评估其改善阿尔茨海默症患者日落症候群症状的效果,以及治疗帕金森病患者的不规律睡眠觉醒节律障碍症状。根据协议,渤健将支付给辉瑞7500万美元的前期付款、可高达6.35亿美元的里程碑付款以及未来销售额的分成。
05股市资讯
.
上个交易日 A 股医药板块 -1.28%
涨幅前三 跌幅前三
香雪制药+10.00% 莱美药业 -5.66%
舒 泰 神 +9.98% 长春高新 -5.18%
华北制药 +8.28% 万孚生物 -4.70%
【贝达药业】收到国家药品监督管理局签发的《受理通知书》,公司申报的BPI-43487胶囊的药品临床试验申请已获得国家药品监督管理局受理。
【九强生物】预计归属于上市公司股东的净利润为33,073.18万元-36,079.83万元,比上年同期增长:10 % -20 %;非经常性损益对净利润的影响为1,828.41万元,主要系收到政府补助款。
【亚宝药业】截止本公告披露日,控股股东亚宝投资已通过集中竞价交易方式累计减持公司股份303.08万股,占公司总股本的0.39%。
06审评动向
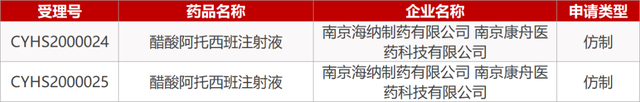
1. CDE最新受理情况(01月14日)
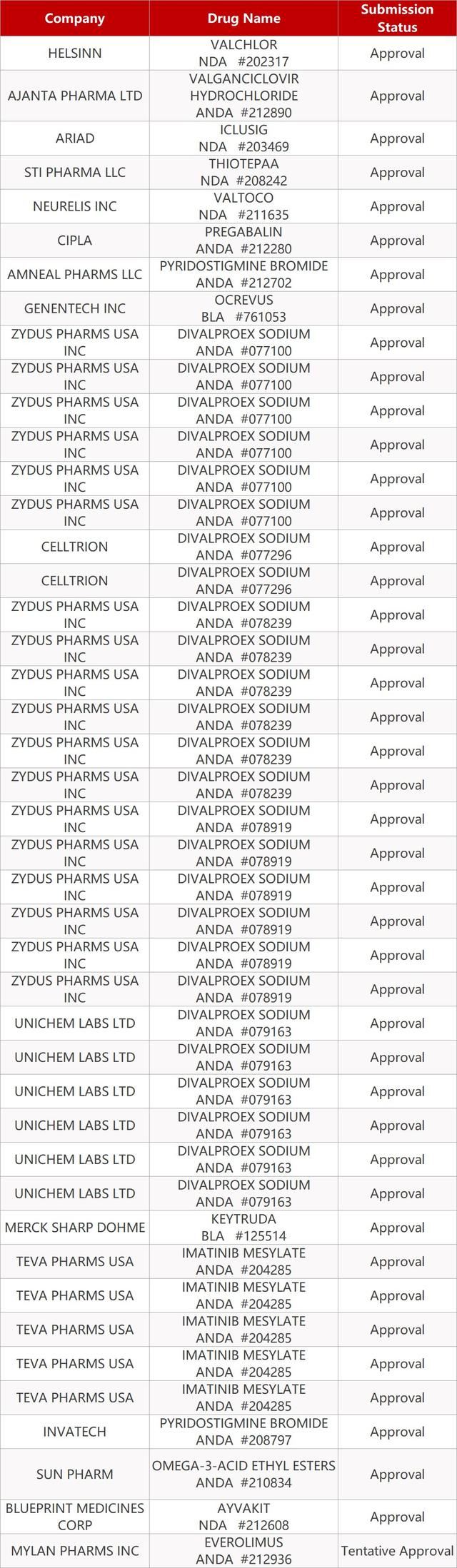
2. FDA最新获批情况(北美01月13日)






















评论