一文读懂新加坡医疗器械市场准入
文章来源:械企必读(思宇MedTech旗下,专注产品注册、市场准入等内容)
转载要求:首发24小时后可转载,需注明来源
在全球化的浪潮下,生物医药企业已将国际化拓展作为重要战略。覆盖近6.7亿人口的东南亚,预计将在2030年成为全球第四大单一市场。该地区吸引了众多药械企业的目光,全球最顶级制药和生物科技公司如艾伯维(AbbVie)、诺华(Novartis)、辉瑞(Pfizer)、罗氏(Roche)、赛诺菲(Sanofi)、雅培(Abbott)等陆续在新加坡建造生产基地,并且深耕东南亚市场。
新加坡完善的法规保障,清晰的审批路径,较大的确定性,这些条件是医药企业快速推进创新药械临床研究及进入市场的保证。新冠疫情中, 企业在新加坡卫生科学局(HSA)的审批依然有序推进。
受美国白宫生物法案(法案内容可参考“械企必读”往期文章《 》)的影响,“出海东南亚”再一次成为医疗创投圈里最热的话题。新加坡或许会成为国内药械企业布局出海东南亚的最受青睐之地!
本文重点介绍新加坡医疗器械市场准入流程、周期及费用。
01
新加坡医疗器械定义及分类
(1)医疗器械定义
在新加坡,“医疗器械”是指单独或组合使用,用于人类如下一个或多个特定目的的任何仪器、器材、机器、器具、植入物、体外试剂、校准器、软件、材料或其他类似的物品:
1)诊断、预防、监测、治疗或减轻任何疾病;
2)损伤的诊断、监测、治疗、缓解或赔偿;
3)解剂或生理过程的研究、替代、调节或支持;
4)支持或维持生命;
5)妊娠控制;
6)医疗器械的消毒:
7)通过对取自人体的样本进行体外检查的方式来提供医疗信息。
(2)医疗器械分类
在新加坡,医疗器械大致分为:常规医疗器械和体外诊断器械(IVD) 两大类;按安全风险高低,又分为A、B、C、D四个类别。
1)新加坡常规医疗器械分类
2)新加坡体外诊断医疗器械分类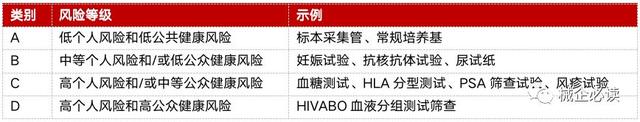
02
新加坡医疗器械监管机构
在新加坡,医疗器械的监管机构是新加坡卫生科学局(Health Sciences Authority, HSA)。HSA 成立于2001年4月,隶属于新加坡卫生部(Ministry of Health (MOH) Singapore) ,是负责监管西药、医疗器械、辅助健康产品、化妆品等产品的新加坡法定机构。HSA享用行政执法权,也拥有一般科研机构或事业单位的独立权和灵活性。
在制定医疗器械的监管框架时,HSA参考了发达国家的医疗器械监管系统,包括美国食品和药物管理局(FDA) 、欧盟公告机构(EU NB)、加拿大医疗器械局(MDB)、日本卫生劳动福利部(MHLW)和澳大利亚治疗用品管理(TGA)等机构,并结合自身情况,摸索出一套适应新加坡情况的医疗器械监管体系。
03
新加坡医疗器械注册
1.新加坡实行与国际接轨的医疗器械分类管理制度,即按安全风险将医疗器械分为A、B、C、D类共4个类别进行管理。
2.根据新加坡《健康产品法令》及《健康产品(医疗器械)条例》的规定,除了豁免产品,所有类别的医疗器械产品都必须经过HSA注册方可在新加坡上市销售。
3.注册人或申请人必须是一家新加坡注册公司,注册人或申请人须通过HSA的医疗器械信息与通讯系统(MEDICS) 在线提交申请。凡是经过注册的医疗器械,都列入新加坡医疗器械注册清单(SMDR) 中,消费者可在线查询所购买的医疗器械是否经过注册。
4.非无菌A类医疗器械可以免除注册,但该类医疗器械仍需符合医疗器械安全与性能的基本要求,不得与相关法律法规相抵触。无菌A类医疗器械(含体外诊断器械)仍需进行注册。部分B类、C类和D类医疗器械如果已经获得美国、欧洲、澳大利亚、日本上市批准,在提供相关证明文件后,可加快注册甚至立即注册。
(1)无菌A类医疗器械注册
1)注册流程
 2)注册提交材料
2)注册提交材料
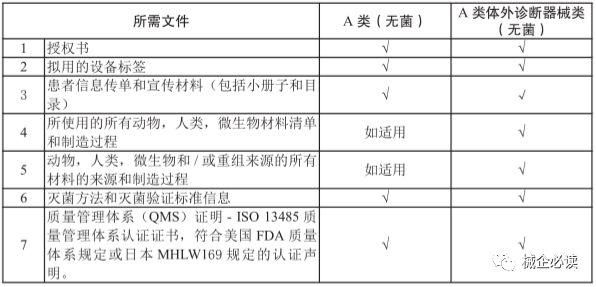
3)注册周期和费用无菌A类医疗器械的注册人或申请人提交申请资料时,需支付申请费约25新元,HSA在30个工作日内对注册资料进行审核并作出决定。
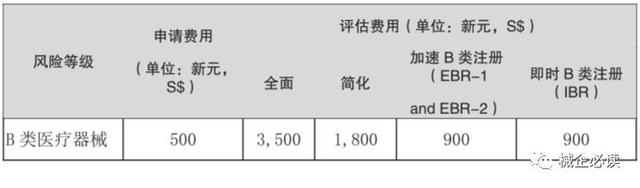
(2)B类医疗器械注册
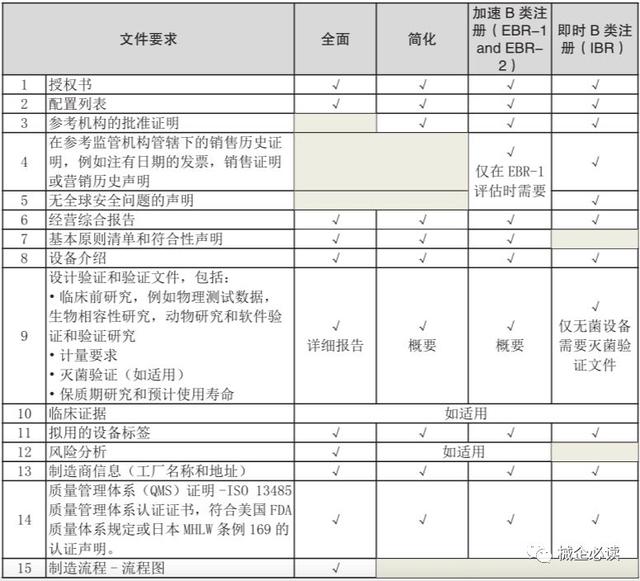
1)B类医疗器械评估路线分类注册前,需对B类医疗器械进行评估,分为四条评估路线:全面评估路线、 简化评估路线、加速B类注册(EBR)评估路线、即时B类注册(IBR)评估路线。
2)B类医疗器械不同评估路线需提交的文件
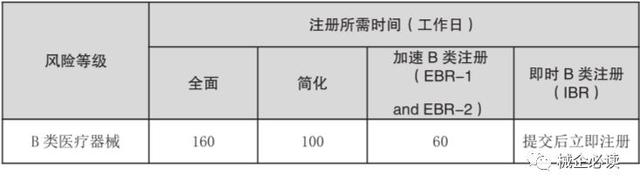
3)B类器械注册周期和费用
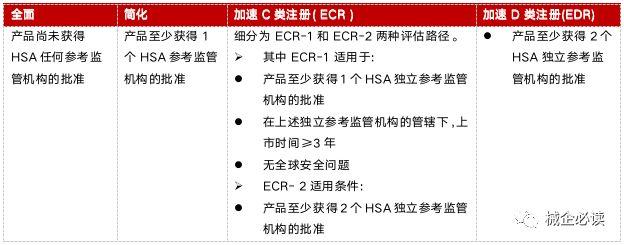
(3)C类/D类医疗器械注册1)C类/D类医疗器械评估路线分类
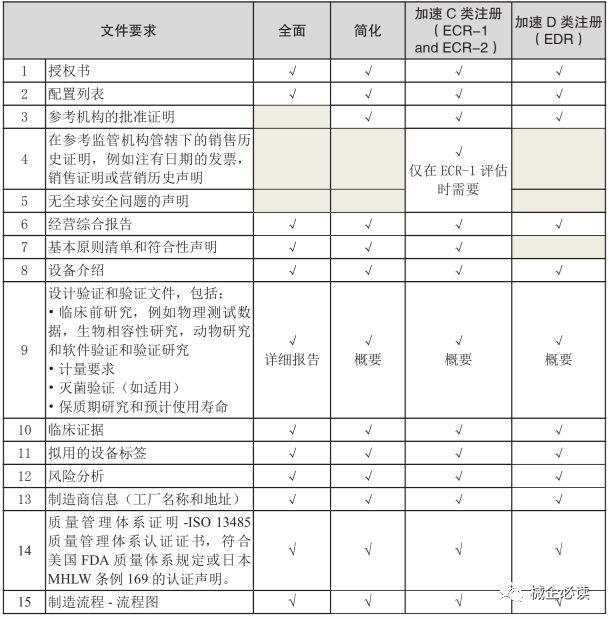
2)C、D类医疗器械各评估路线所需提交的资料
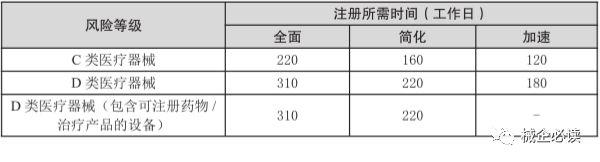
3)C、D类器械注册周期和费用
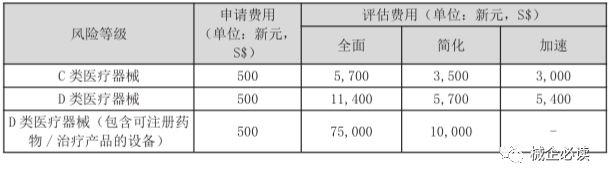
参考资料:何丽钦. 新加坡医疗器械市场准入解读[C]//.第十四届中国标准化论坛论文集.,2017:1266-1274.




















评论