免疫疗法首突破!阿斯利康 PD-L1 单抗获 FDA 批准一线治疗胆道癌
9 月 2 日,美国 FDA 宣布批准阿斯利康的 PD-L1 单抗「度伐利尤单抗」新适应症,联合化疗一线治疗胆道癌。
度伐利尤单抗是近 10 年来首个在一线胆道癌全球 III 期临床中取得 OS 突破的免疫疗法。本次批准有望撼动胆道癌一线标准化疗的地位,为相应患者带来更好的生存获益。

来自:FDA 官网
胆道肿瘤(BTC)是起源于胆囊及胆管的恶性肿瘤的总称,其发病率约占所有消化系统肿瘤的3%。其分型包括胆囊癌(GBC)、肝内胆管癌(ICC)和肝外胆管癌(ECC),ECC 根据解剖位置又分为肝门部胆管癌(PCC)和远端胆管癌(DCC)。
目前,BTC 全球发病率呈现上升趋势,以亚洲国家最为常见。其中,以 GBC 最为常见,全球发病率位居消化道肿瘤第6位;近年来我国 ICC 发病率也在逐年升高。
由于 BTC 起病隐匿,侵袭性强且对常规放化疗不敏感,因此 BTC 的预后极差,5 年生存率仅5%-15%。长期以来,晚期 BTC 的一线标准治疗都是以吉西他滨联合顺铂(GC)化疗方案为主,然而其临床疗效并不尽如人意。
此前,FDA 仅批准了 3 款胆道癌靶向药,而未有免疫疗法获批。这三款胆道癌治疗药物都在 2020 年及 2021 年才刚刚获批,其中两款为 FGFR 抑制剂,信达/Incyte 的佩米替尼(Pemigatinib)和联拓/BrigeBio 的 Infigratinib;一款为 IDH1 抑制剂艾伏尼布,由Agios Pharmaceuticals开发,基石药业引进。目前佩米替尼和艾伏尼布已经在国内获批上市。
全球获批上市的胆道癌靶向化药

来自:Insight 数据库网页版
免疫疗法在胆道癌进展不算顺利,甚至可以说坎坷,2021 年默克的 PD-L1/TGFβ双特异性融合蛋白 M7824 在这一适应症上惨遭一线二线二连败。
而据Insight 数据库显示,除度伐利尤单抗外,全球另有 5 款抗体药针对胆道癌在开展III 期临床,国内企业冲在最前线 ,包括正大天晴的 TQB2450、康宁杰瑞/思路迪的恩沃利单抗和君实的特瑞普利单抗。
这三者在疗法类型则各有区别:TQB2450 联合安罗替尼二线治疗胆管癌、恩沃利单抗联合化疗一线治疗胆道癌、特瑞普利单抗则联合仑伐替尼和化疗用于胆管癌新辅助治疗。
胆道癌领域抗体药研发进度(临床 III 期)
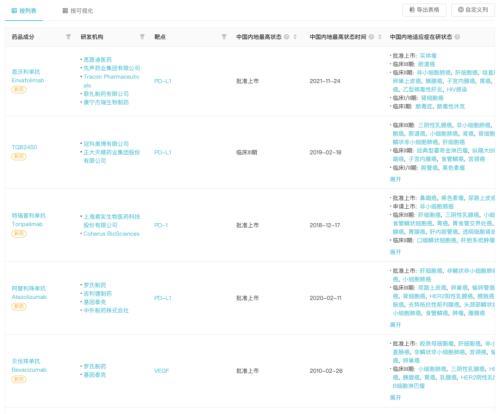
来自:Insight 数据库网页版
作为首个在一线胆道癌全球 III 期临床中取得积极结果的免疫疗法,Imfinzi 此前也凭借这项适应症获得 FDA 孤儿药资格认定。本次批准之后,胆道癌患者终于迎来了新的一线治疗方案。
Imfinzi:延长患者 OS
降低疾病进展或死亡的风险25%
阿斯利康最早于 2021 年 10 月宣布度伐利尤单抗联合化疗一线治疗晚期胆道癌(BTC)的 III 期临床 TOPAZ-1 在中期分析中达到了总生存期(OS)主要终点,次年1 月 18 日在 2022 ASCO GI 上公布了 TOPAZ-1 研究数据。
TOPAZ-1是一种随机、双盲、安慰剂对照全球多中心 III 期临床试验,评估 Imfinzi 联合化疗(吉西他滨+顺铂)相较于安慰剂联合化疗一线治疗不可切除的晚期或转移性 BTC 患者的疗效和安全性。该试验在全球纳入685 名患者,主要终点为总生存期(OS),关键次要终点包括无进展生存期(PFS)、客观缓解率(ORR)以及安全性。
在预先确定的中期分析中,与单独化疗相比,接受Imfinzi 联合疗法的患者死亡风险降低了 20%(基于 0.80 的风险比 [HR];95% 置信区间 [CI],0.66-0.97;双侧 p=0.021)。中位 OS 为 12.8 个月,而化疗为 11.5 个月。25% 的患者在两年内仍存活,而接受化疗的患者为 10%。
结果还显示, Imfinzi 联合化疗可使疾病进展或死亡的风险降低 25%(HR,0.75;95% CI,0.64-0.89;双侧 p=0.001)。联合治疗的中位 PFS 为 7.2 个月,而化疗为 5.7 个月。接受 Imfinzi 联合化疗的患者的客观缓解率 (ORR) 为 26.7%,而单独接受化疗的患者的 ORR 为 18.7%。
安全性方面,Imfinzi联合化疗耐受性良好,与对照组相比具有相似的安全性,并且与单独化疗相比,不会增加因不良事件导致的停药率。
TOPAZ-1 临床试验结果
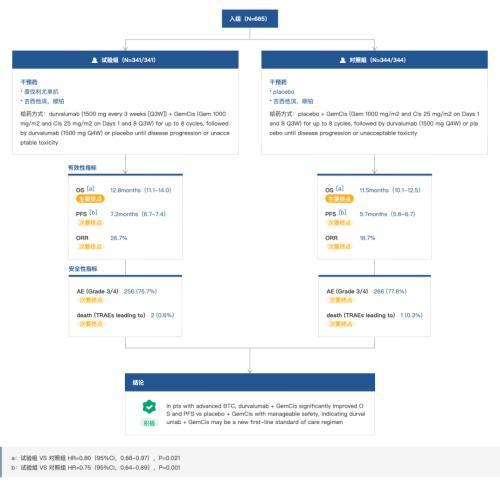
来自:Insight 数据库网页版
5 月 4 日,阿斯利康宣布 PD-L1 单抗 Imfinzi(度伐利尤单抗)联合化疗一线治疗胆道癌的新适应症上市申请(sBLA)获 FDA 受理,并授予优先审评。仅隔 4 个月,这项新适应症就通过FDA 肿瘤学卓越中心的 Orbis 项目获得批准。FDA 新闻稿中表示,这项审评中也与澳大利亚,加拿大,新加坡和瑞士的监管机构进行了合作。
本文源自Insight数据库





















评论