几种海洋抗肿瘤药物的研究进展

已知在人类居住的地球表面,浩瀚的海洋占据了70%以上的地表面积,海洋也是地球上生命的摇篮。据推测,某些海洋生态系诸如珊瑚或深海底的生物多样性,可超过陆地热带雨林。很多海洋动物诸如无脊椎动物都具有柔软的身体,而且营固着生活。这些海洋生物为维持生存,在进化长河中具备了化学防御能力。它们可以自我合成,或从海洋微生物包括微动物和微植物中获得毒性化合物,从而通过麻痹和毒杀,制服海洋环境中的捕食者和竞争者以及猎物。种类繁多的海洋微生物所合成的这些次级代谢物,绝大多数迄今尚未被人类所利用,但现已越来越清楚地认识到,大量的海洋生物产物有望成为冶疗人类疾病有效的和特异的良药。
据报道,海洋抗肿瘤活性物质一直是海洋药物研究的重点。海洋生物提取物中至少10%具有抗肿瘤活性,海洋植物中提取的化合物3.5%有抗癌活性或细胞毒活性。迄今仍处于临床或临床研发早期阶段,但目前已有一些海洋生物药,例如阿糖胞苷、曲贝替定、脱氢膜海鞘素、艾瑞布林等已经面市,本文就这几个已上市的海洋抗肿瘤药物做简要的概述。
阿糖胞苷

阿糖胞苷是第一个在临床上应用的海洋抗肿瘤药物,1969年6月由FDA批准上市。阿糖胞苷主要作用于细胞S增殖期的嘧啶类抗代谢药物,通过抑制细胞DNA的合成,干扰细胞的增殖。阿糖胞苷进入人体后经激酶磷酸化后转为阿糖胞苷三磷酸及阿糖胞苷二磷酸,前者能强有力地抑制DNA聚合酶的合成,后者能抑制二磷酸胞苷转变为二磷酸脱氧胞苷,从而抑制细胞DNA聚合及合成。为细胞周期特异性药物,对处于S期增殖期细胞的作用最敏感,对抑制RNA及蛋白质合成的作用较弱。其功能主治主要用于急性白血病:对急性粒细胞白血病疗效最好,对急性单核细胞白血病及急性淋巴细胞白血病也有效,一般均与其他药物合并应用。对恶性淋巴瘤、肺癌、消化道癌、头颈部癌有一定疗效,对病毒性角膜炎及流行性结膜炎等也有一定疗效。
阿糖胞苷(Cytarabine,Ara-C)是以来源于加勒比海海绵Cryptotethia crypta的一种特异海绵核苷类化合物为先导合成的衍生物,加利福尼亚大学伯克利分校的Richard Walwick等于1959年首次合成。
曲贝替定(Yondelis,trabectedin,ET-743)

2003年,西班牙生物技术公司PharmaMar公司开发的药物Yondelis® (trabectedin(曲贝替定)),用于治疗转移性或晚期软组织肉瘤,其报批申请被欧盟人用医药产品委员会(CHMP)的前身CPMP断然拒绝,理由为其若干关键性临床试验的方法学存在问题。PharmaMar在发现和研制取自海洋的抗癌药方面处于全球领先地位,它拥有丰富的药物产品和强大的研发实力。其总部设在马德里,是Zeltia S.A.旗下子公司。PharmaMar公司当时曾就此问题提起上诉,但未果,因此不得不基于本品的一项STS-201Ⅱ期临床试验数据再次申报,加上公司后来公布的另外补充的3项l临床研究数据,加强了本品疗效的说服力。
2007年9月该药在欧洲获得治疗晚期软组织肉瘤的许可。Yondelis®是一种全新的、多模块合成的抗癌药,最初从海鞘身上提取制得。该药物通过不同的药物作用机制阻止肿瘤发展,包括捆绑DNA(脱氧核糖核酸)阻止细胞再生、抑制活化转移和蛋白质参与DNA修复、改变肿瘤微环境。
2009年9月Yondelis®获得了欧洲药品局医药产品委员会人类卵巢癌使用的积极推荐,该药当前与强生的聚乙二醇脂质体Doxil(阿霉素)组合用于治疗卵巢癌,2009年11月2日Yondelis®和Doxil以联合疗法治疗卵巢癌获欧洲监管机构批准上市,这一新的适应症的获批也是众望所归。
该组合药已被批准在包括挪威、冰岛以及列支敦士登在内的27个欧盟国家上市。但是其首批投放的国家有英国、澳大利亚、德国、丹麦、瑞士、芬兰以及挪威等。现在Yondelis®在全球77国家中均有销售,是一种用于治疗晚期软组织肉瘤的单一药物;在70个国家中它与Doxil一起治疗复发的铂敏感卵巢癌。
与欧洲大相径庭的是,2009年9月美国FDA因为安全问题过大和疗效并不显著等原因拒绝了Yondelis和Doxil联合疗法的上市申请,其中包括该公司正在进行的关键试验,以及进一步临床药理学研究的总体生存率数据。两年后因为同样原因,公司被迫暂停了这一项目并将其转向恶性肉瘤的研发。
2014年11月24日,PharmaMar在美国研发Yondelis®的战略合作伙伴Janssen Research & Development(杨森研发有限公司)提交了新药上市申请。2015年2月4日PharmaMar对外宣布美国FDA同意优先审核Yondelis®用于包括脂肪肉瘤和平滑肌肉瘤亚型在内的晚期软组织肉瘤(STS)患者的新药上市申请(NDA)。这些患者前期曾接受过一种含蒽环类药物的治疗。
2015年10月23日,美国食品药品监督管理局(FDA)批准化疗药Yondelis®用于治疗不可切除的或晚期(转移性)脂肪肉瘤和平滑肌肉瘤,获批的两项适应症是这种肿瘤中恶性程度较高的类型,其适应人群是既往接受过蒽环类化疗药物治疗的患者。
ET-743是一个分子中含有3个四氢异喹啉单元,8个环以及1个含半胱氨酸残基的10元内脂杂环,7个手性中心的复杂生物碱类化合物。Kerr等通过标记氨基酸证明其生物合成途径是来源于两分子络氨酸缩合成环二肽,后经过氧化为羟基二酮哌嗪类化合物,从而结合进入到ET-743分子中。
ET-743的各项研究开展后,就需要持续不断的生产,科学家们通过系统的研究,于1996年,Corey等首次报道了ET-743的全合成,但经过30多步反应得到目标产物,总收率仅为0.75%。2000年Corey对之前自己课题组报道的路线进行了优化,提高了收率,适用于工业化生产。实际上,Trabectedin(曲贝替定)的来源是通过其类似物Cyanosafracin B半合成而来,而Cyanosafracin B由生物发酵法获得公斤级的产物。
ET-743抗肿瘤的作用机制独特而复杂,参与了多种机制:可以使DNA双螺旋小沟处的鸟嘌呤的N-2烷基化,阻断DNA的复制与合成,抑制肿瘤细胞的分裂生长;抑制遗传修复途径;干扰细胞周期导致p53依赖性的程序性死亡,扰乱肿瘤细胞微观网络;在DNA和拓扑异构酶Ⅰ之间引起交联。如下图所示:
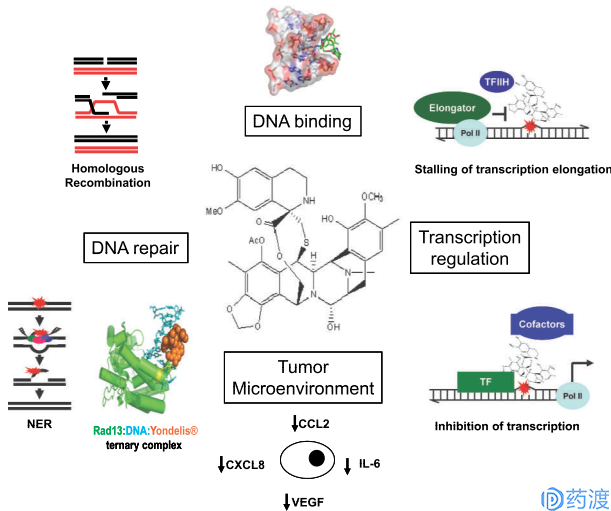
曲贝替定(Yondelis,trabectedin,ET-743)的抗癌作用机制
阿普立定(Aplidin,脱氢膜海鞘素,plitidepsin,dehydrodidemnin B)

脱氢膜海鞘素(Aplidin,plitidepsin,dehydrodidemnin B)从被囊动物膜海鞘科动物中分离出的提取物,有强细胞毒活性,后经分离精制得膜海鞘素A、B、C,为脂肽类环状缩肽,由肽键部分与非肽键联成。现已发现海鞘类生物活性物质有显著的抗病毒及抗肿瘤作用,可望开发为新颖的药物。膜海鞘素B能抑制DNA和RNA病毒,P388白血病小鼠存活期能延长99%,对于B16黑色素瘤小鼠的存活期可延长60%,膜海鞘素B比A作用更强,在低浓度时(0.01%μg/ml持续作用)对乳腺癌、卵巢癌、肾癌及肉瘤等均有明显活性,在免疫抑制话性与目前临床上常用的免疫抑制剂类固醇激素等相比,其作用要高出100-1000倍。NCI对膜海鞘素B的Ⅱ期临床主要针对胃癌、膀胱癌、前列腺癌、多发性骨髓癌和急性淋巴白血病等,目前Ⅲ期临床正在进行中。2003年,欧洲药品管理局(EMA)授权其作为急性淋巴细胞白血病孤儿药。现今已引起了全球对海鞘的广泛兴趣,已发现的膜海鞘素约有12个,而更多的衍生物正在进行一系列的研究,有望发现疗效更好、毒副作用更低的新颖性抗肿瘤药物。
1987年,Rinehart等首次报道了didemmin族化合物的全合成研究,后续有不少课题组也在进行一系列的相关研究。而阿普立定的经典合成方法是Jou等于1997年报道的,他们利用BOP、PyBrOP、PyAOP、HBTU、HATU等一系列磷盐多肽缩合试剂来合成酰胺产物,收率高,可获得大量的目标化合物。
阿普立定在体内外实验都表现出较好的抗肿瘤活性,如甲状腺癌、结肠癌、淋巴癌和肾癌等。对人白血病细胞系MOLT-4的研究表明,阿普立定的作用机制是抑制细胞生长和促使细胞凋亡。阿普立定抑制MOL-4细胞的生长和诱导细胞凋亡不是通过直接影响VEGF的转录或其mRNA的稳定性,而是通过抑制VEGF的分泌从而阻断癌细胞生长所必需的VEGF/VEGFR-1自分泌回路实现的。但是阿普立定抑制VEGF分泌的作用机制尚不完全清楚,阿普立定的主要作用或许是导致一系列的级联反应,包括抑制新VEGF、mRNA的合成和下调VEGFR-1受体的表达,阻断其FIT-1的自分泌环。而阿普立定的细胞毒素作用对增殖细胞有明显的选择性,c-Jun N端JNK的激活是其诱导细胞凋亡的关键。
艾瑞布林(Eribulin,Halaven,E7389,ER-086526)

艾瑞布林是一种非紫杉烷类新型抗微管剂,它可结合在微管链的不同位点,一些Ⅱ期试验显示它可有效治疗若干肿瘤类型。研究显示除导致微管物理性破裂外,还存在一些潜在的机制或可引起更好的疗效和更低的毒性。到目前为止,仅有一项Ⅲ期临床试验的结果支持其用于乳腺癌,另一项Ⅲ期试验对其治疗转移性肺癌的疗效正在进行中,将会揭示艾瑞布林用于此种临床的优点。目前的数据支持艾瑞布林可潜在应用于乳腺癌、肺癌、前列腺癌、尿路上皮癌、软组织肉瘤。2010年11月15日,美国FDA批准了日本卫材(Eisai)公司研发的甲磺酸艾瑞布林(Halaven)用于治疗曾接受至少两种抗癌药物,包括蒽环类和紫杉烷类药物治疗的转移性乳腺癌患者。其可基于微管蛋白的抗有丝分裂机制,使细胞周期停滞于G2/M期,破坏有丝分裂纺锤体,最终诱导肿瘤细胞凋亡。2011年甲磺酸艾瑞布林已陆续在新加坡、欧盟和日本上市,其在日本的适应症为不可手术治疗及复发性乳腺癌。目前,卫材(Eisai)公司正在进行本品单独治疗未经治疗的乳腺癌、非小细胞肺癌、肉瘤和前列腺癌等的后期临床研究。
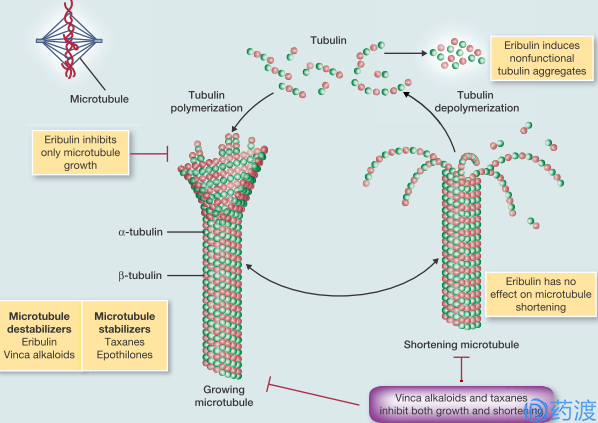
艾瑞布林的抗癌作用机制
艾瑞布林的抗癌机制是通过与微管蛋白水溶性的一端相结合,减少了游离可溶性微管蛋白的数量,打破了微管与可溶性微管蛋白之间聚合和解聚的动态平衡,使得平衡向微管蛋白方向移动,有微管蛋白从微管上解聚下来。另外它还通过PI3K通路、血管和上皮间质的转化等通路抑制细胞内的信号传导。艾瑞布林是一种新型抗微管剂,已证明其对多种肿瘤具有治疗活性,包括经其他抗微管剂药物既往治疗的肿瘤。更多新出现的关于乳腺癌细胞的数据显示,艾瑞布林的活性不仅在于其抗有丝分裂作用,还涉及到细胞内信号,包括PI3K-Akt-mTOR枢纽、EMT血管生成和重建作用。艾瑞布林联合靶向上述机制的其他药物共同治疗是否有效则还需要进一步的研究,目前这些试验正在进行中。
艾瑞布林为海绵Halichondria okadai中的halichondrin B的合成类似物,其合成工艺相当复杂,全合成路线共有62个反应步骤。艾瑞布林结构中含有19个手性碳原子,理论上有52.4万个立体异构体,尽管立体控制存在极大的困难,但卫材(Eisai)制药凭借雄厚的技术实力,艾瑞布林的立体选择性控制难题已经得到解决,并实现了工业化生产。
结语
众所周知,海洋占地球表面的70%,是迄今所知最大的生命栖息地,海洋中有机物的品种是陆地上的两倍,因此,大多数科学家都坚持认为,海洋药物的研究将会给不断遭受疾病灾难的人类带来更多的希望。广袤无垠的大海中还存在着许多不为人知的生物资源,这些资源都有待我们去探索和研究。世界海洋天然产物的开发正方兴未艾,走在这一领域前列的是美国、日本及欧盟,最近发展很快的是韩国。这些科技发达国家投入可观的科研经费,对海洋药物进行开发和研究。在过去的几十年间,6000多种海洋天然产物被发现,其中有重要生物活性并已申请专利的新化合物有200多种,而在70年代只有少数几个有关前列腺素的专利申请,80年代至今则数量大增。在已发现的这些化合物中,不仅包括陆地生物中已存在的各种化学类型,并且还存在很多独特的新颖化学结构类型,尤其重要的是从海洋生物中发现了一系列高效低毒的抗肿瘤化合物,目前世界上至少已有15个以上海洋抗癌药物进入临床或临床前研究阶段。希望在不远的将来人类能够从浩瀚的海洋中寻找到更多抵抗人类各种疾病的海洋药物。
参考文献
[1] 刘鹏.海洋生物技术与海洋生物制药的研究进展[D].2011.2.
[2] 司玫,展翔天.海洋生物活性物质研究进展[J].中国海洋药物,2003年06期.
[3] 郭跃伟.欧洲海洋药物的研究现状及对我国海洋药物研究的启示[J].中国新药杂志,2001年第10卷第2期:p81.
[4] Murray H.G.等. 张鹤林,张吉德译.从海洋生物寻找抗病毒及抗癌化合物.中国海洋药物杂志,1990,9 (4),49
[5] Kuznetsov G,Towle MJ,Cheng H,Kawamura T,TenDyke K,Liu D,Kishi Y,Yu MJ,Littlefield BA (August 2004). 'Induction of morphological and biochemical apoptosis following prolonged mitotic blockage by halichondrin Bmacrocyclic ketone analog E7389'. Cancer Res. 64 (16): 5760-5766.
[6] Thomas D. Aicher,Keith R. Buszek,Francis G. Fang, Craig J. Forsyth,Sun Ho Jung,Yoshito Kishi,Michael C. Matelich,Paul M. Scola,Denice M. Spero,Suk Kyoon Yoon. Total synthesis of halichondrin B and norhalichondrinB. J. Am. Chem. Soc,1992,114 (8),pp 3162–3164.
[7] Cragg, G.M. & Newman,D.J. (2004).'Marine natural products and related compounds in clinical and advanced preclinical trials'. Journal of Natural Products. 67 (8): 1216–1238.
















评论