免疫疗法延长肝癌患者总生存期;首款NASH疗法有望明年诞生
▎药明康德/报道
超越一线标准疗法!Tecentriq组合提高肝癌患者总生存期
罗氏(Roche)公布PD-L1抗体 Tecentriq(atezolizumab,阿替利珠单抗)联合Avastin(bevacizumab,贝伐珠单抗)的组合疗法,在治疗既往未接受过全身治疗的不可切除肝细胞癌(HCC)患者的3期试验IMbrave150中取得积极结果。数据显示,与索拉非尼相比,Tecentriq/Avastin组合将患者死亡风险降低42%,使疾病进展或死亡风险降低41%。这一免疫组合疗法是10年来首个通过临床研究证实优于现有标准疗法索拉非尼的全新疗法。
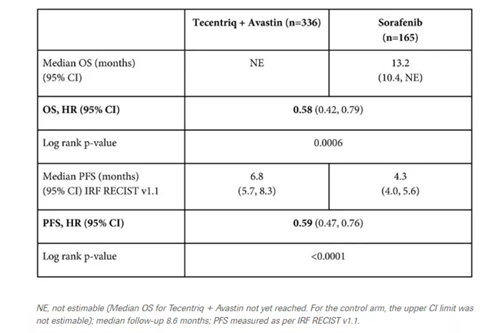
▲Tecentriq/Avastin组合与索拉非尼相比,一线治疗肝细胞癌患者的试验结果(图片来源:罗氏公司官网)
PD-L1抑制剂Tecentriq已经在美国、欧盟等国家和地区获得批准,可以单独使用,也可以与靶向疗法或化疗联合使用,用于各种形式的非小细胞和小细胞肺癌、某些类型的转移性尿路上皮癌,以及PD-L1阳性转移性三阴性乳腺癌。Avastin是针对血管内皮生长因子(VEGF)的抗体,通过直接结合VEGF干扰肿瘤的血液供应,抑制肿瘤生长和扩散。Tecentriq加Avastin的组合疗法可能增强免疫系统对付广泛癌症的潜力。2018年7月,美国FDA授予Tecentriq/Avastin组合疗法突破性疗法认定,一线治疗晚期或转移性HCC。
镰状细胞贫血症“攻坚战”!FDA提前加速批准小分子创新疗法
美国FDA宣布,加速批准Global Blood Therapeutics公司的创新疗法Oxbryta(voxelotor)上市,治疗成人和12岁以上青少年患者的镰状细胞贫血症(sickle cell disease, SCD)。这是首款FDA批准的靶向血红蛋白聚合过程的创新疗法,代表着治疗SCD的一种创新作用机制。这一批准比FDA预定的批准时间提前了3个月,显示了FDA为将这款创新疗法早日带给患者而作出的努力。
Voxelotor是一款每日口服一次的SCD创新疗法,它通过增加血红蛋白对氧的亲和力达到疗效。由于氧合镰状血红蛋白不会聚合,voxelotor可防止红细胞发生镰状改变以及血红细胞的损毁。Voxelotor有着恢复正常血红蛋白功能和改善氧气输送的潜力。
Voxelotor曾经获得美国FDA授予的突破性疗法认定、孤儿药资格、快速通道资格和罕见儿科疾病认定(rare pediatric disease designations)。
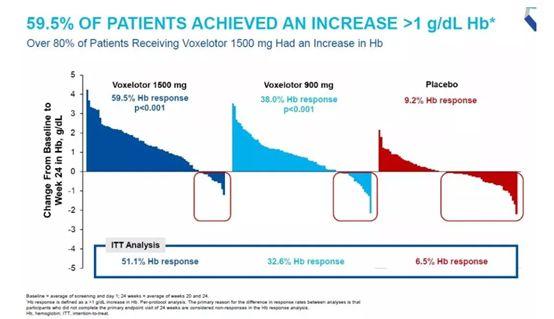
▲Oxbryta在HOPE临床试验中的主要疗效结果(图片来源:Global Blood Therapeutics公司官网)
Oxbryta的批准是基于包含274名SCD患者的临床试验的结果,在这项试验中,SCD患者接受不同剂量的Oxbryta或安慰剂的治疗。试验结果表明,接受剂量为1500 mg的voxelotor患者组中59.5%的患者血红蛋白水平提高超过1 g/dL,安慰剂组这一数值为9.2%。以往研究表明,血红蛋白水平降低与负面临床后果相关,而将血红蛋白水平提高1 g/dL可能显著降低SCD患者临床并发症和死亡率。
2020年3月迎接首款NASH疗法?Intercept奥贝胆酸获FDA优先审评资格
Intercept Pharmaceuticals公司宣布,FDA接受该公司为奥贝胆酸(OCA)递交的新药上市申请(NDA),并且授予其优先审评资格。这一NDA寻求加速批准OCA上市,治疗由于非酒精性脂肪性肝炎(NASH)导致的肝纤维化。OCA是目前唯一在3期临床试验中获得积极结果的NASH疗法。如果获得批准,这将是第一款获批治疗NASH导致的肝纤维化的创新疗法。FDA预计在明年3月26日之前作出回复。
OCA是一种强力的特异性法尼醇X受体(FXR)激动剂。FXR是调节肝脏健康的关键核受体,它可以对多重生理过程进行调节,包括胆酸代谢、炎症发生、纤维化、糖代谢和脂类代谢。OCA是FXR天然配体的类似物,它的效力比天然配体强100倍。在临床前模型中,它能够通过多种机制改善NASH症状,其中包括直接抗纤维化效果。OCA是目前唯一获得FDA突破性疗法认定治疗NASH肝纤维化的在研疗法。
这一申请是基于名为REGENERATE的3期临床试验的积极中期分析结果。今年2月,Intercept公司宣布,OCA在这一3期临床试验中达到主要终点,显著改善肝脏纤维化。在4月召开的欧洲肝脏研究协会(ESAL)年会上,Intercept公司公布了这一试验的详细结果。
总计2480名NASH患者加入了REGENERATE试验,他们随机接受不同剂量的OCA(10 mg或25 mg),或安慰剂的治疗。这项试验具有两个主要终点,分别为肝纤维化程度改善一级以上,同时NASH症状没有恶化;或者NASH症状消除,肝纤维化程度没有恶化。这也是FDA指南中认可的临床终点。
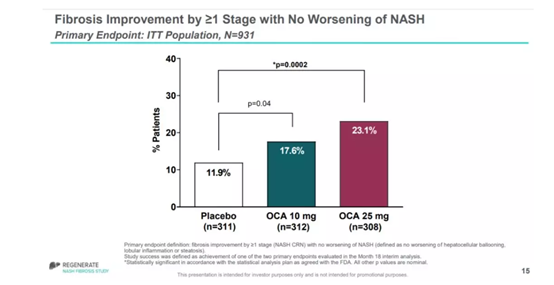
▲OCA的主要疗效数据(图片来源:Intercept Pharmaceuticals公司官网)
试验结果表明,在接受治疗18个月时,接受不同剂量OCA治疗的意向治疗(ITT)患者群中,肝纤维化改善超过1级,同时NASH症状没有恶化的患者比例为17.6%(10 mg)和23.1%(25 mg),安慰剂组这一数值为11.9%。目前这项试验仍在进行中。
连中三元!Keytruda在中国连续获批一线治疗非小细胞肺癌
默沙东公司(MSD)宣布,中国国家药监局(NMPA)批准该公司的重磅PD-1抑制剂Keytruda,与卡铂或紫杉醇联用,一线治疗转移性鳞状非小细胞肺癌(NSCLC)患者。新闻稿指出,这是Keytruda在中国一年里第三次获批一线治疗NSCLC。目前,Keytruda与化疗的组合已经获批一线治疗鳞状和非鳞状NSCLC患者,并且Keytruda单药疗法获批一线治疗表达PD-L1的NSCLC患者(TPS>1%)。
在新加坡举办的ESMO Asia 2019大会上,默沙东公布了3期临床试验KEYNOTE-407研究中国亚组(包括中国扩展队列)中期分析数据,该研究旨在评估默沙东PD-1抑制剂帕博利珠单抗联合化疗,对比安慰剂联合化疗,一线治疗转移性鳞状NSCLC患者的有效性和安全性。

研究数据显示,在KEYNOTE-407中国扩展研究中,帕博利珠单抗联合治疗组较单纯化疗组降低了56%的死亡风险,两组中位总生存期(OS)分别为17.3个月比12.6个月;帕博利珠单抗联合治疗组较单纯化疗组降低了68%的疾病进展或死亡风险,两组中位无进展生存期(PFS)分别为8.3个月比4.2个月。
值得一提的是,KEYNOTE-407中国扩展研究中,帕博利珠单抗联合组较单纯化疗组降低了56%的死亡风险,而全球研究中这一数据为29%。可见,帕博利珠单抗联合化疗在中国患者群中的疗效优于全球患者群。
儿童和青少年1型糖尿病患者福音!赛诺菲长效胰岛素获批扩展适应症
美国FDA批准扩展赛诺菲(Sanofi)公司的长效甘精胰岛素注射液Toujeo适用范围,用于治疗6岁及以上1型糖尿病儿童和青少年患者。基于11月初公布的EDITION JUNIOR试验结果,欧洲药品管理局(EMA)人用药品委员会(CHMP)也建议批准扩展适应症。此前,Toujeo仅获批治疗18岁及以上成年患者。
Toujeo的胰岛素含量是标准的1mL胰岛素的3倍(100单位/ mL),在2015年获得美国FDA批准上市。胰岛素的主要活性是调节葡萄糖代谢,通过刺激外周葡萄糖摄取,尤其是刺激骨骼肌和脂肪对葡萄糖的摄取,以及通过抑制肝葡萄糖的产生来实现降低血糖的效果。

这一批准主要基于一项名为EDITION JUNIOR的试验结果。该试验旨在验证Toujeo在治疗6至17岁1型糖尿病患者中的疗效。试验结果显示,治疗6个月后,与Toujeo Gla-100相比,Toujeo治疗组中的患者实现了降低糖化血红蛋白水平(HbA1c)的非劣效性标准,达到研究的主要终点。此外,该组患者中酮症和严重低血糖症(<54 mg/dL)的发生率都相对更低,具有管理血糖波动的有效性。
“剑指”胆管癌!Incyte创新疗法获FDA优先审评资格
Incyte公司宣布,美国FDA已经接受其FGFR1/2/3抑制剂pemigatinib的新药申请(NDA),用于治疗携带FGFR2基因融合或重排的局部晚期或转移性经治肝内胆管癌(iCCA)患者。FDA同时授予该申请优先审评资格,预计将在明年5月30日前作出回复。
Pemigatinib是靶向FGFR1,2和3的口服小分子抑制剂,其临床前数据体现了针对发生FGFR2基因变异的肿瘤的优异疗效和安全性。此前,FDA已授予pemigatinib治疗胆管癌的突破性疗法认定和孤儿药资格。

图片来源:Incyte官网
此次NDA的递交是基于pemigatinib在名为FIGHT-202的2期试验中治疗局部晚期或转移性经治肝内胆管癌患者的有效性和安全性数据。试验结果显示,在携带FGFR2基因融合或重排的患者亚组中,pemigatinib的单药治疗使患者达到36%的客观缓解率(ORR),并使中位缓解时间(DOR)达到7.5个月。
靶向罕见神经疾病!ZX008获优先审评资格
致力于开发罕见病疗法的Zogenix公司宣布,美国FDA已经接受该公司为Fintepla(ZX008,口服低剂量氟苯丙胺)递交的新药上市申请(NDA),治疗与Dravet综合征相关的癫痫发作。FDA同时授予这一NDA优先审评资格,预计在明年3月25日之前作出回复。
Zogenix公司开发的ZX008是一种液体形态的低剂量氟苯丙胺。它可以通过调节血清素机制和sigma-1受体活性来减少癫痫发作的频率。ZX008已经获得美国和欧盟授予的孤儿药资格,同时它获得了美国FDA授予的突破性疗法认定。
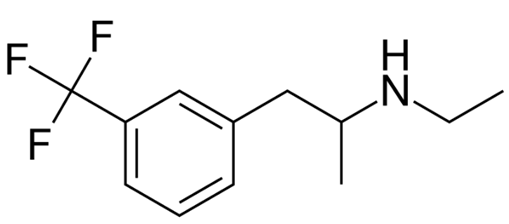
▲氟苯丙胺分子结构式(图片来源:Brenton [Public domain])
这一申请是基于两项关键性3期临床试验的数据以及一项正在进行中的开放标签扩展试验的中期分析结果。这些试验包括232名患者,接受治疗时间最多长达21个月。在其中一项关键性3期临床试验中,Fintepla与安慰剂组相比,每月平均出现痉挛性癫痫发作的次数减少了54.7%(p<0.001)。
“猎杀”小细胞肺癌!Imfinzi获FDA优先审评资格
阿斯利康(AstraZeneca )宣布美国FDA接受了其免疫疗法Imfinzi(durvalumab)的补充生物制剂许可申请(sBLA),并授予该申请优先审评资格。在明年第一季度结束前,FDA将做出批复。值得注意的是,本申请的适应症为先前未接受过治疗的广泛期小细胞肺癌患者。这也意味着Imfinzi有望在罗氏的Tecentriq之后,很快成为第二款获批一线治疗小细胞肺癌的PD-L1抑制剂。

作为一款PD-L1抑制剂,Imfinzi在一项名为CASPIAN的3期临床试验中展现出了积极的治疗效果。与标准化疗连用的情况下,它能显著延长患者的总生存期(OS)。数据显示,患者的死亡风险能减少27%,中位总生存期为13.0个月。相比之下,只使用标准化疗的对照组,其数据为10.3个月。在治疗的18个月后,治疗组的患者里有33.9%依旧存活。这一数字在对照组为24.7%。这一研究的结果也在今年早些时候发表在了《柳叶刀》上。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。





















评论