新冠抗原自测产品来了!谁生产?谁销售?来看华大基因、万孚生物等最新回应
记者 | 郭净净
编辑 |
3月12日以来,国家药监局已批准5款新冠抗原自测产品上市。相关产品主要来自诺唯赞(688105.SH)、华大基因(300676.SZ)、万孚生物(300482.SZ)等三家A股上市公司,已经完成创业板上市辅导的北京华科泰生物,以及北京金沃夫生物。
近日,包括诺唯赞、华大基因、万孚生物、明德生物(002932.SZ)、热景生物(688068.SH)、迈克生物(300463.SZ)、美诺华(603538.SH)、乐普医疗(300003.SZ)、九安医疗(002432.SZ)、鱼跃医疗(002223.SZ)等多家A股新冠检测概念公司均发布其新冠抗原自测产品的最新进展。
3月13日,万孚生物披露,旗下新型冠状病毒(2019-nCoV)抗原检测试剂盒(胶体金法)收到国家药监局颁发的《医疗器械注册变更文件》。变更后,产品用于体外定性检测口咽拭子、鼻咽拭子、鼻拭子样本中新型冠状病毒N抗原,增加了鼻拭子样本的采样方式。“上述产品的实际销售情况受新冠疫情变化、防控政策、检测需求、公司供应链能力变化、物流运输风险以及不可预计或不可抗力等多因素影响,公司尚无法预测该产品对未来业绩的具体影响。”2020年9月,该公司旗下新冠抗原检测产品就完成欧盟CE认证,并于同年11月获国家药监局应急审批通过。
此前3月10日、11日,万孚生物连收两个涨停板。同时,针对网上流传的万孚生物新冠抗原检测试剂盒产品组织团购等信息,该公司3月12日坦言,发现有部分个人及公司未经万孚生物合法授权,擅自通过电商以及其他线上渠道进行非法售卖宣传。对此,该公司声明:“我公司对该医疗器械产品的销售实行严格管理,如未获得我公司合法授权,不得擅自对外销售以及进行虚假宣传活动。对于上述未经我公司合法授权、擅自通过电商以及其他线上渠道、宣称可销售我公司研发的新冠抗原检测产品的个人及公司,公司保留向相关公安部门报案并追究相应法律责任的权利。”
3月13日,华大基因公告,控股子公司华大因源于近日取得国家药监局颁发的《中华人民共和国医疗器械注册变更文件(体外诊断试剂)》,对新冠抗原检测产品的医疗器械注册证进行了变更。该公司称,本次医疗器械注册证的变更增加了华大因原新冠抗原检测产品的适用范围,有助于满足整体疫情防控的多样化检测场景,有利于提高公司的综合竞争力。“上述产品实际销售情况受政策、市场竞争及新冠疫情发展状况等多种因素影响,公司目前尚无法预测其对公司未来业绩的影响。”
3月11日,华大基因股价大涨11%。2020年12月,华大基因旗下新冠抗原检测产品就通过国家药品监督管理局应急审批,获得了医疗器械注册证;并于2021年2月获得欧盟CE准入资质及获得沙特阿拉伯食品药品管理局批准上市。
3月13日,诺唯赞披露,全资子公司诺唯赞医疗于2022年3月12日取得由国家药监局审批通过的《医疗器械注册变更文件(体外诊断试剂)》。“上述变更事项进一步响应了国家新冠疫情防控与检测政策,有助于进一步提升公司在相关领域的竞争力。上述新型冠状病毒抗原检测产品的实际销售情况受新冠疫情变化、防控政策及检测需求等多因素影响,公司尚无法预测该产品的销售对未来业绩的具体影响。”3月11日,该公司股价大涨17.47%。
此外,于3月10日、11日连收两个涨停板的明德生物,于3月13日发布公告称,相关新冠核酸检测试剂,公司已于2020年3月获批,并持续为公司带来销售收入;公司新冠抗原检测试剂已向国家药监局提交注册申请,该注册证的取得时间尚存不确定性。同时该公司称,2022年以来,各地为防控疫情进行大规模新冠核酸检测筛查带来新冠核酸检测试剂和服务需求的增加,预计将带来公司新冠核酸检测试剂订单及相关收入大幅增长;“公司目前尚无法预测上述事项对公司业绩的具体影响,未来随着疫情逐步得到控制,相关新冠检测产品和服务的需求预计无法持续”。
3月13日,乐普医疗在互动平台上称,公司自主研发的新冠抗原检测自测试剂先后获得了欧盟CE、德国BfArM等注册证,将会积极销往欧洲、东南亚等注册证认可的地区,并申请其他海外国家的注册认证以扩大可销售范围,公司会积极拓展国内外渠道助力疫情防控。该公司还称,已对新型冠状病毒变异毒株Omicron(B.1.1.529)突变位点进行序列比对分析,所有突变位点均在公司选择的新冠配对单抗识别的表位区域之外,因此根据生物信息学分析,公司的新冠抗原检测自测试剂可有效检出。
三维天地(301159.SZ)3月13日在互动平台表示,公司检验检测信息化系统可应用于居民自测盒、试剂等生产企业。
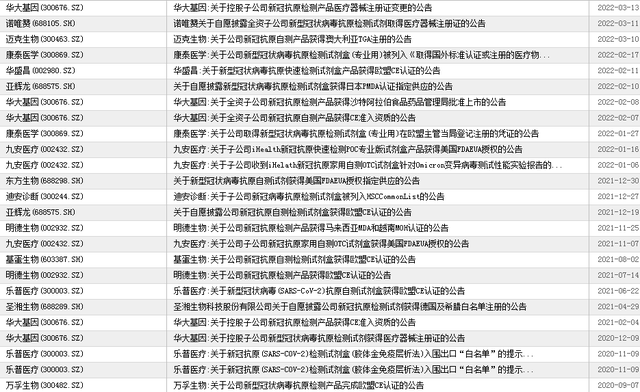
3月12日,美诺华微信公众号称,近日,旗下美诺华锐合基金参股企业美克医学技术有限公司COVID-19业务主要产品为COVID-19抗原检测、COVID-19抗原自检、COVID-19抗体检测等。该公司研发的COVID-19抗原检测等产品已经获得了欧盟CE证书、德国BfArM授权、澳洲TGA认证、法国白名单认证等来自多个国家和地区的多项授权认证,销往中国香港、德国、法国、奥地利、南美、沙特、阿联酋、阿根廷等四十多个国家和地区。3月8日至11日,该公司已经连收四个涨停板,股价累涨46.42%。
热景生物于3月11日称,旗下新冠抗原检测试剂盒(前鼻腔)近日获得新加坡卫生科学局(HSA)批准,可在新加坡和认可新加坡(HSA)认证的国家及地区进行销售。公开信息显示,2021年1月,该公司旗下新冠抗原测定试剂盒(化学发光免疫分析法)就获得欧盟CE认证。3月10日、11日,该公司股价分别大涨11.58%、11.17%。
3月11日,东方生物则指出,截止目前,公司新冠抗原检测试剂尚未取得国内认证证书。据了解,该公司旗下美国衡健生物科技有限公司(HEALGENSCIENTIFICLLC)的客户SIEMENSHEALTHINEERS(简称“西门子医疗”)的“CLINITEST”新型冠状病毒抗原自测试剂于北京时间2021年12月30日取得FDAEUA紧急使用授权,公司本次作为西门子医疗该抗原自测产品的指定授权供应商。本产品获得美国紧急使用授权(EUA)后,可在美国公共卫生健康应急期间,在美国和认可美国EUA的国家/地区销售。3月10日、11日,东方生物股价分别大涨13.59%、18.01%。
3月11日收获涨停板的鱼跃医疗回复投资者称,公司自主研发的新冠抗原检测产品分为院用版与家庭自测版,其中院用版已通过CE认证,家庭自测版的欧盟CE认证和美国FDA紧急使用授权(EUA)公司尚在积极推进中。
另据界面新闻了解,迈克生物于3月10日称,公司新冠抗原自测产品获得澳大利亚TGA注册。2月17日,康泰医学(300869.SZ)新冠抗原检测试剂盒(专业用)被列入《取得国外标准认证或注册的医疗物资企业清单》,意味着该产品已允许进行海外销售。华盛昌(002980.SZ)于2月11日称,新冠抗原快速检测试剂盒产品获得欧盟CE认证。2月10日,亚辉龙(688575.SH)披露,新冠抗原检测试剂盒获得日本PMDA认证指定供应。
1月14日,九安医疗宣布,其子公司iHealth新冠抗原快速检测POC专业版试剂盒产品获得美国FDAEUA授权,并且已与美国ACC签署抗原自测试剂盒采购合同并生效,合同价税合计金额高达12.75亿美元,合81.02亿元人民币。
去年12月,迪安诊断(300244.SZ)下属子公司研发的新冠病毒抗原检测试剂盒被列入欧盟卫生安全委员会HSCCommonList(欧盟通用白名单)。2021年8月,基蛋生物(603387.SH)新冠抗原自测检测试剂盒获得欧盟CE认证。圣湘生物(688289.SH)新冠抗原检测试剂于去年4月获得德国及希腊白名单注册。
除了研发生产渠道,新冠抗原自测产品的销售通道也已经打开。
老百姓(603883.SH)公众号3月12日消息,老百姓大药房与万孚生物达成合作,首批产品将登陆老百姓大药房位于上海、湖南、江苏等12个省市的门店,预计将于14日上午起在线下门店和线上同步上架销售。
大参林(603233.SH)表示,公司与万孚生物已就新冠抗原自测试剂的分销签订战略合作协议,万孚生物新冠抗原自测试剂首批销售将在大参林线下和线上的终端渠道启动。
平安好医生(01833.HK)宣布,首批新冠抗原自测试剂盒即将上线。阿里健康旗下天猫健康、京东健康宣布与国内首批获得国家药监局“新冠抗原自测”产品批准的多家企业达成销售合作。
美团买药上线新冠抗原自测产品,用户自3月13日起预约购买相关产品;同时美团买药也已经联合老百姓大药房、国大药房、高济医疗、海王星辰、大参林药房、泉源堂药房等多家连锁药店,预计将在一周内与线下药店同步上架新冠抗原自测产品。叮当快药将推出“新冠抗原居家自测”28分钟配送到家服务。


















评论