2018全球慢性乙型肝炎在研新药研发进展盘点
注:本文为肝脏时间微信公众号略晓薛一家之言,其中个人观点必有不少纰漏和错误,个人搜索最新数据能力也有限,欢迎广大读者指正和批评并提供最新数据供大家共享。本文目的在于分享更多公开信息,拓展在研乙肝新药认知,欢迎掌握更多相关信息读者将文中未能提及的信息分享出来大家共享。文中涉及几乎所有数据均可在肝脏时间微信公众号或一诺医学网站的原创文章中找到,相关数据均来源国内外企业和研究所公开公布信息,可在各大官方网站或期刊以及会议论文摘要中查得,对详细数据感兴趣的读者可去肝脏时间微信公众号历史文章中或到一诺医学网站中或者国外相关官网查找。本文涉及参考文献量非常多,故在文末中省略,敬请见谅!
据发表在2018年3月的柳叶刀子刊(The Lancet Gastroenterology & Hepatology)上的最新研究结果表明,全球目前约有3.0亿左右的慢性乙肝病毒感染者(包括慢性乙型肝炎患者和乙肝病毒携带者),其中主要集中在东亚,南亚,拉哈拉以南的非洲等地区[1],由于慢性乙型肝炎病毒感染者众多,现已经成为全球重要的公共卫生问题。
乙型肝炎病毒(HBV)感染的迁延不愈可导致肝纤维化、肝硬化甚至肝细胞肝癌。现阶段我国约有1亿的慢性乙肝病毒感染者,而我国每年新发肝癌病例约占据全球的59%,这其中绝大多数肝癌病例由乙肝病毒感染和丙肝病毒感染所导致。丙肝病毒感染自2013年首款口服直接作用抗病毒药物(DAA)面世后目前治愈率已经达到95%以上,而慢性乙型肝炎的治愈则仍有待基础研究和药物研究的突破。
目前已批准可用的慢性乙型肝炎治疗药物有干扰素类和核苷(酸)类似物两大类。前者代表药物有聚乙二醇干扰素α-2a(派罗欣)、聚乙二醇干扰素α-2b(佩乐能)和普通干扰素,国内近期获批上市的乐复能(Novaferon)本人认为属于类干扰素类药物;后者代表药物有拉米夫定、阿德福韦酯、恩替卡韦、替比夫定、Levovir (Clevudine)、Besivo (besifovir) 、富马酸替诺福韦二吡呋酯(TDF)、替诺福韦艾拉酚胺(TAF)。但这两大类药物均只能通过抑制病毒复制来延缓病情,治愈率非常有限,无法实现大范围的彻底治愈,多数使用口服药物的患者需要终生用药。部分患者在现有药物治疗过程中不少出现耐药,甚至包括替诺福韦(TDF)耐药(韩国2017年已有公开的耐药病例报道)。针对替诺福韦耐药病例,研究人员认为新型作用机制药物或成为唯一选择,因此,开发新型治疗方法毫无疑义成为当前迫切需求。
乙肝病毒从进入人体附着到肝细胞并在肝细胞内组装再释放到血液过程中有多重步骤(参见下图)。目前的核苷(酸)类似物通过抑制病毒DNA多聚酶和逆转录酶的活性,同时竞争性抑制核苷酸进入病毒DNA链,终止病毒DNA链的延长,干扰病毒DNA的合成,从而发挥抗病毒作用。干扰素则并不直接杀伤或抑制病毒,主要通过细胞表面受体作用使细胞产生抗病毒蛋白,从而抑制乙肝病毒的复制;同时还可增强自然杀伤细胞(NK细胞)、巨噬细胞和T淋巴细胞的活力,从而起到免疫调节作用,并增强抗病毒能力。而新型治疗药物将靶点瞄向乙肝病毒全生命周期中各个环节,包括靶向乙肝病毒进入肝细胞、HBx蛋白、cccDNA形成、RNA干扰、HBsAg形成分泌等等,进而开发针对单一靶点或同时作用多个靶点的治疗药物。这些药物目前已有部分进进入临床研究试验,但也有部分仍处在临床前研究阶段。
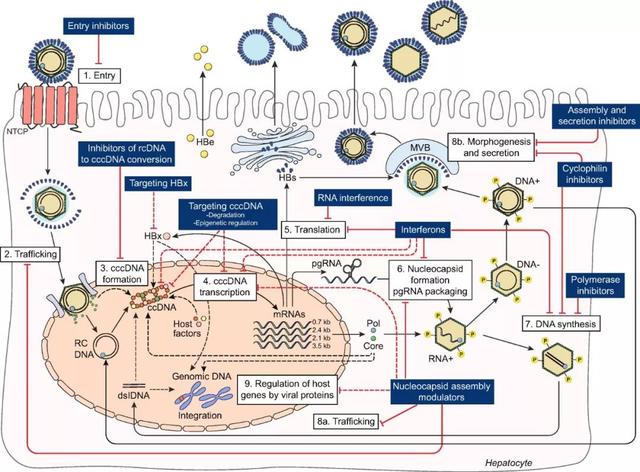
图片来源:柳叶刀子刊(The Lancet Gastroenterology & Hepatology)
以下仅就本人掌握的2108年有公开进展消息的在研乙肝新药进行简要介绍:
1. 核苷(酸)类似物
当今慢乙肝治疗药物中使用量最大的药物非核苷(酸)类似物莫属,此类药物虽无法彻底治愈、停药后也极易反弹、且用药过程中的耐药问题也较为突出,但作为当前可选不多的药物之一实属无奈。目前国内外均有不少厂家对此类药物进行更新换代,其中主要以开发替诺福韦(TFV)的前药为主。
海普诺福韦(HTS)
海普诺福韦为西安新通药物研究有限公司和广州奇方药业有限公司共同申报的1.1 类新药,据悉,该药日前已获批准进入临床研究。该药物为西安新通在其具有自主知识产权的国家“十三五”重大新药创制“HepDirect”技术平台基础上研制的第二代乙肝靶向新药,属于替诺福韦前药,能靶向性地将药物活性产物投放到肝脏,浓集于肝脏,达到增效减毒作用。大鼠研究表明,该药的肝肾比是替诺福韦的13.4倍,在具有更强和更持久疗效的同时,可以显著改善肾功能和骨骼安全参数。动物药理研究显示,相比替诺福韦,海普诺福韦的用量更小,停药后二周病毒无明显反跳,有望开发为低毒长效口服制剂。
HS-10234片
HS-10234是翰森制药(豪森药业)自主研发的抗病毒1.1类创新药,是一种核苷类逆转录酶抑制剂,预期可用于乙肝治疗。HS-10234是新一代单磷酰胺单酯类的替诺福韦前药,在血浆中非常稳定,因此可提供一种既能提高疗效又能降低毒性与副作用的新型替诺福韦前药。目前正进行HS-10234的III期临床试验,预计于2019年向国家食药监总局提交新药申请,并于2020年在中国获批上市。
TXL (CMX 157)
TXL (CMX 157)是美国 ContraVir 公司开发的在研新药,是一种新型的无环核苷膦酸酯替诺福韦(TFV)前体药物。药物通过酯化作用将TFV转化成部分类脂,再借助细胞的自然脂类吸收路径,使口服生物利用度和细胞靶向作用获得提升,药物在细胞内通过将CMX157转化成TFV二磷酸的形式发生作用。
2018年3月TXL (CMX 157)获得美国食品药品监督管理局(FDA)授予用于儿童(0至11岁)慢乙肝治疗的孤儿药资质。
目前该药已经在做 Phase II 期临床并在确定最佳的用药剂量(从目前做的试验看估计最终剂量跟TAF不相上下),在跟富马酸替诺福韦二吡呋酯(TDF)进行对照的 II 期研究中该药的安全性和耐受性良好,不良反应发生率和实验室检查结果异常两者相似,没有因药物严重不良反应而停药的事件发生,没有剂量限制性毒性或剂量依赖不良反应事件。
而在患有严重肾损伤(RI)受试者中进行的 phase I 期开放标签研究显示,该药50mg每日的剂量观察到替诺福韦(TVF)暴露与300mg替诺福韦(TDF)暴露相当,表明该药对于严重肾损伤(RI)患者不需要进行剂量调整。
国内有关该药的消息:据福建省肝病药物研究重点实验室近期公开公布的2018年度开放课题评审结果通知显示,国内企业南京天海医药科技有限公司正式开始对 ContraVir 公司的在研乙肝新药CMX157(现在正式名称:TXL)及其类似物的合成展开研究工作(个人理解为仿制)。
2.RNA干扰(RNAi):干扰和破坏病毒RNA
RNA干扰(RNAi)技术诞生于上世纪90年代,是研究人员在研究秀丽新小杆线虫(C. elegans)反义RNA(antisenseRNA)过程中发现的,是一种生物在进化过程中高度保守的、由双链RNA(double-strandedRNA,dsRNA)介导的同源RNA高效特异性降解现象。2006年两位美国人因在RNAi机制研究中的贡献获得诺贝尔生理及医学奖,12年后的2018年,首款RNAi疗法药物获得美国药品监管部门批准上市,随后欧洲药品监管部门也批准了该疗法药物的上市,药物是由 Alnylam 公司研发用于成人遗传性转甲状腺素蛋白(hATTR)淀粉样变性引起的周围神经病变治疗的新药ONPATTRO? (patisiran)脂质复合物注射液。
针对慢乙肝治疗RNAi主要靶向乙肝病毒的前基因组RNA(pgRNA)和mRNA水平。自发现至今已有较多研究人员将该技术用于乙型肝炎病毒感染的治疗探索,现已有多款采用RNAi 技术的药物进入人体临床试验。较有代表性的要数 Arrowhead 公司的 ARC-520、ARC-521 和 ARO-HBV,Alnylam 公司的 Vir-2218(ALN-HBV02),Arbutus 公司的ARB-1467 、ARB-1740 和 AB-729 ,Roche 公司的 RG6004 ,Benitec 公司的 BB-103,Arcturus公司的 Lunar-HBV,Dicerna 公司的 DCR-HBVS。
ARC-520
ARC-520 是由 Arrowhead 公司研发的一款针对慢乙肝的RNAi新药,也是最早进入Phase II期临床的RNAi在研乙肝新药,用的是 Arrowhead 公司的专有技术EX1进行药物递送。该药研发进程并非一帆风顺,临床研究期间被暂停过后又获得重启,然而在2016年11月由于出现用药非人类灵长类动物的死亡最终公司还是决定终止了该药物的研究,相较而言该药用于人体的临床试验还较为安全。
在今年的欧肝会上,Arrowhead 公司还公布了患者在使用了 ARC-520 停药半年后的随访结果,在该结果中观察到HBeAg阳性患者 HBsAg 平均下降 3.0 log ,max 下降4.6log,有1例患者实现 HBsAg 水平下降到 1 IU/ml以下。HBeAg 阳性患者 HBcrAg 平均下降 3.4 log ,max 下降 6.1log。HBeAg阴性患者 HBsAg 平均下降 1.0 log ,max 下降2.1log, 但只有1名患者 HBcrAg 下降 0.7 log 并且仍处于阳性状态。
另据今年发表在 Science Translational Medicine 杂志上的该药用于慢性HBV感染者和黑猩猩的研究治疗表明整合到宿主基因组中的 HBV DNA 可作为 HBsAg 的来源,该研究主要研究人员 Christine I. Wooddell 博士说“对该领域来说这是一个重要的发现并具有广泛的影响,因为以前认为病毒蛋白的产生仅仅依赖于乙肝病毒cccDNA的转录。我们现在可以知道,整合 HBV DNA 也是可以生产循环 HBsAg 的一种方式,而不是仅仅依赖于病毒复制,其还可能在持续抑制免疫系统中起作用,并允许持续的病毒粒子生产。只要有几个能够逃避免疫监视的含cccDNA 的细胞就可以保持持续的慢性感染,因此,只有实现对 HBsAg 的完全免疫控制方可以预防停药后的感染复发,并实现功能性治愈。”
ARC-521
ARC-521是Arrowhead 公司开发的第二款针对慢乙肝治疗的RNAi新药,作为ARC-520的补充,该款药物公司更希望针对的是那些低 cccDNA水平的患者。然而在Arrowhead计划在健康志愿者和HBV患者中进行关于ARC-521 的单剂量和多剂量Phase 1/2 期临床试验后不久,便曝出采用EX1技术递送药物的非人类灵长类动物死亡,最终公司还是决定同ARC-520一样终止了ARC-521的研究。
ARO-HBV
自终止了ARC-520 和ARC-521 的研究研究后,Arrowhead 公司利用专有的皮下(subQ)和肝外输送系统重新开发了 RNAi 疗法药物,用于慢乙肝治疗的药物目前已知有 ARO-HBV,该药已经开始了Phase I/II期临床试验。
在旧金山召开的 2018 美国肝病学会(AASLD)年会上 Arrowhead 公司公布了该药Phase 1 期临床试验结果。结果显示健康志愿者组和慢乙肝患者组用药后均没有严重的AE病例报告,两组的AE均为轻度,约有11%的注射受试者发生轻度注射部位AE,总体而言耐受性良好。
而受试的慢乙肝患者在与NUC联合用药后 HBsAg 的最大降幅高达4.0 log10,并且已经到第85天监测时间点的各个剂量组( 100, 200, 300 或 400mg 用药)慢乙肝患者均实现HBsAg降低> 1.0 log10。在第二剂和第三剂用药后还观察到了额外的HBsAg降低。
在研究的24名慢乙肝患者中,21名基线时HBsAg> 100 IU / ml,目前有17名达到HBsAg<100, 7名≤10, 4名≤1。基线时其他病毒参数均在LLOQ以上的慢乙肝患者中,ARO-HBV 用药后均有所改善,包括降至BLQ以下的:HBV DNA(2/7),HBV RNA(8/14),HBeAg(0/11)和 HBcrAg( 3/15)。
Vir-2218(ALN-HBV02)
Vir-2218 是 Alnylam 公司用增强稳定化学加(ESC +)GalNAc结合物递送平台开发用于慢乙肝治疗的 RNAi 新药,之前称为ALN-HBV02,公司将其授权给Vir Biotechnology进行临床开发后改名为 Vir-2218 。最近公司已跟Vir Biotechnology联合宣布将 VIR-2218 推进 Phase 1/2 期临床。
VIR-2218 的设计初衷旨在抑制所有HBV蛋白的表达,包括乙型肝炎表面抗原(HBsAg)。有研究认为病毒蛋白的敲低可能有助于恢复患者自身对HBV的免疫反应,从而为患有慢性HBV感染的人提供功能性治愈的潜力。目前暂未有更多关于 VIR-2218的详细研究信息披露。
之前Alnylam 公司曾开发过另一款用于慢乙肝治疗的 RNAi 新药ALN-HBV,并于2016年将其推进到了Phase 1/2期临床,之后没有进一步的消息公布。这款新药是采用增强稳定化学(ESC)-半乳糖胺-RNA干扰共轭传递平台开发,VIR-2218 与 ALN-HBV 的开发平台有所不同。在啮齿类HBV感染动物模型中的临床前研究数据表明,皮下注射ALN-HBV能够产生强大而持久的使HBsAg下降的能力。在小鼠单剂量的ALN-HBV研究中,单剂量应用后15天能够引起最高达3.6log10,平均1.6 log10 HBsAg的下降。此外,在大鼠ALN-HBV多剂量应用表现出更高强度的下降,ALN-HBV 3mg/kg的剂量每周一次,持续三周,效果可持续长达4个月。在大鼠和灵长类动物13周的药品非临床研究质量管理规范(GLP)毒理学研究中 ALN-HBV 的耐受性良好。
ARB-1467
ARB-1467 是 Arbutus 公司使用专有的脂质纳米颗粒(LNP)递送技术开发用于慢乙肝治疗的一代 RNAi 药物,是一种含有三个双链小干扰RNA(siRNA)的脂质纳米颗粒(LNP)制剂,其靶向乙肝病毒基因组中的三个不同位点,以实现由cccDNA和整合DNA产生的HBV蛋白的转录后基因抑制,包括乙肝表面抗原(HBsAg)。临床前研究中该药表现出了降低乙肝病毒抗原如 cccDNA 和 HBV DNA 水平的能力。
据此前公布的Phase 2a/2b期临床研究结果,队列1-3(共24例,含对照受试者)中接受核苷类似物治疗已稳定控制病毒的慢乙肝患者接受每月一次用药,共3剂,队列4为每两周用药一次,共5剂。队列1-3中持续用药患者的 HBcrAg 和 HBsAg 降低较多,6/11 对象的 HBsAg 降低大于 1 log,其中队列2 以0.4mg/kg 的用药剂量观察到的 HBsAg 下降幅度要比 0.2 mg/kg 用药剂量的队列1更大。队列4(12名受试者)所有患者均经历血清乙肝表面抗原(HBsAg)水平下降,平均下降 1.4 log10(最大下降2.7 log IU/mL),比之前每月用药一次的队列1-3患者下降幅度大,12名患者中有7名达到预定的应答标准(血清 HBsAg 下降至少1个log10 且血清HBsAg水平低于1000 IU/mL)。
新研究已经正在进行,采用每两周用药一次,为期30周,并跟核苷(酸)类似物和干扰素进行联合用药研究,主要评估在有限的治疗期内对当前治愈率改善情况。迄今为止,已有6名HBV患者入组并接受了治疗。根据方案,3名患者在第6周未达到预定的应答标准以进行PEG-IFN治疗。 2名患者尚未进展至6周分析点以确定是否需要添加PEG-IFN。1名患者的反应强烈,治疗第14周时HBsAg水平降低3.17 log,低于4 IU / mL,基线水平大于6000 IU / mL,表明该方案可能使某些患者的HBsAg水平降低到无法检测水平。该研究仍然在继续入组新的受试对象,公司将定期提供数据更新。
ARB-1740
ARB-1740 是 Arbutus 公司开发的二代RNAi疗法药物,ARB-1740使用的是跟ARB-1467同样的脂质纳米颗粒(LNP)递送技术,区别在于它使用了不同的RNAi触发分子(RNAiTrigger Molecules)。在临床前试验中,ARB-1740彰显出了更大的潜力。但在Phase II期临床中发现该药的效用与ARB-1467相比无明显的优势,因此,Arbutus决定终止开发ARB-1740,继而继续推进ARB-1467。
AB-729
AB-729 是一种靶向HBV的皮下注射GalNAc结合物,是 Arbutus 公司正在开发的第二代RNAi制剂。在临床前研究中,AB-729 显示出有效且持久的HBsAg降低。该药物预计将于2019年第二季度进入临床研究,并可能在2019年下半年的临床研究中与AB-506(一种用于乙肝治疗的在研核心蛋白变构调节剂(CpAM))联合使用。
RG6004(RO7062931、HBV LNA)
RG6004 是 Roche 公司的一款针对慢乙肝治疗的在研RNAi药物,根据公开消息显示该款药物正在进行Phase 1期临床试验,目前未见有关该药的详细公开信息。
LUNAR-HBV
LUNAR-HBV 是 Arcturus公司跟强生公司旗下杨森联合开发的一款针对慢乙肝治疗的药物,是一种3个UNA寡聚物的组合,靶向所有的HBV转录物并涵盖所有的公开的HBV序列,是迄今为止报道的单一药剂中HBV基因型覆盖最全面的。LUNAR-HBV在HBV感染的人肝细胞和两种HBV感染的小鼠模型中显示出有效的抗HBV活性。3个UNA寡聚物的组合也使病毒耐药性发生的可能性最小化。基于其有效的降低HBxAg和其他病毒产物,以及重新激活抗病毒免疫的潜力,LUNAR-HBV有可能成为新一代HBV疗法的基石。
目前该药仍处在临床前研究阶段。
DCR-HBVS
DCR-HBVS 是 Dicerna 公司开发的一款针对慢乙肝治疗的RNAi疗法药物,DCR-HBVS靶向HBV信使RNA,并能使HBV感染小鼠模型中循环HBsAg减少99%以上。公司在2018AASLD上发表的研究结果显示,在给表达HBV基因组的小鼠用药后,靶向HBsAg编码区内的 GalXC 制剂表现出了优异的活性持续时间,并且还抑制了cccDNA转录活性指标的核HBcAg的积累。
目前该药仍处在临床前研究阶段。
BB-103
BB-103 是 Benitec 公司使用RNA干扰(RNAi)技术设计用于慢乙肝治疗的重组腺相关病毒8型(AAV8)基因治疗载体。该载体使用三个野生型pol III启动子来驱动三个短发夹RNA的表达,每个嵌入在miRNA主链内,以同时靶向HBV病毒RNA上的核心,S抗原和X蛋白区域中的三个保守序列。
在嵌合小鼠模型研究中,BB-103 单药治疗70天,跟未治疗PXB小鼠相比,单剂量BB-103 使血清 HBV DNA下降1.98 log。BB-103 联合 PegIFN 的血清 HBV DNA 下降 2.85 logs。 BB-103 联合恩替卡韦在70天内 HBVDNA 水平降到检测下限以下。虽然56天的恩替卡韦治疗 HBsAg只降了0.39 logs,而单剂量的 BB-103 用药治疗 HBsAg 却降了2.05 logs,在加用恩替卡韦后 HBsAg 更是降了2.07 log。类似的,BB-103 单药治疗后HBeAg 水平降低 1.71 logs,而跟恩替卡韦联用后也只降了 1.71 logs 。
然而,由于该药物使用病毒衣壳进行全身递送较具挑战性,实际制造也有不少挑战,于是 Benitec 公司对该药物进行了改进,在突破了具有产生持久基因表达能力的封闭末端线性双链(Closed-Ended Linear Duplex,CELiD)DNA载体药物递送技术后,公司将该药物使用该技术在HBV小鼠模型中进行验证,用药第70天,CELiDDNA导致血清 HBV DNA 降低1.75log(低于LLOQ)。与对照组相比,CELiD DNA 使血清 HBsAg 降低 1.89 log , HBeAg 降低 0.89log (均低于LLOQ)。在整个70天的实验中,HBV病毒载量持续下降,血清HBV参数没有反弹。
目前该药仍处在临床前研究阶段。
3.进入抑制剂:干扰HBV进入肝细胞
2012年北京生命科学研究所李文辉团队率先发现并提出钠离子-牛磺胆酸-协同转运蛋白(NTCP)受体是HBV 感染细胞的功能性受体,病毒进入抑制剂的研究大门由此开启,该类药物通过对肝细胞表面 NTCP 受体的抑制进而防止乙肝病毒进入正常肝细胞。目前针对此类药物的研究已有较多,但多数尚未开展临床试验,已开展临床试验的有代表性的要数 MYR Pharma 公司的 Myrcludex B ,其它如环孢菌素A(CsA)、环孢菌素A衍生物、依泽替米贝、原花青素、罗格列酮(rosiglitazone)、扎鲁司特(zafirlukast)、TRIAC 、柳氮磺胺吡啶(sulfasalazine)、滂胺天蓝(chicago sky blue 6B)等在体内外实验环境中被证明可以一定程度的抑制NTCP受体从而限制 HBV 感染,但目前均未见有公开的临床试验报道。
Myrcludex B
Myrcludex B 是 MYR Pharma 公司研发的首款病毒进入抑制剂,也是目前唯一一款进行了临床试验的病毒进入抑制剂,它的抗病毒作用机制为高度特异性、高度稳定的结合和失活肝细胞表面蛋白NTCP,通过阻断NTCP,MyrcludexB 误导 HBV 和合并感染的HDV到非生产性途径,从而防止正常细胞感染。
Phase 2a临床研究结果显示,40例HBeAg阴性慢乙肝患者(所有HBV DNA>2000 IU/ ml,平均HBV DNA为4.7log10 IU/ml;无肝硬化),每日使用一次Myrcludex B sc 0.5mg、 1mg、 2mg、 5mg 和 10mg 治疗12周(每种剂量8例患者)。有3例Myrcludex B 治疗患者 (10mg组) 发生注射侧皮炎,经治疗后消失。观察到8例接受10mgMyrcludex B治疗的患者中有6例(75%)在第12周出现HBV DNA下降>1log10,而其他剂量组中未见(7/40;17%)。 40例患者中有22例(55%)ALT恢复正常,平均ALT值从治疗前的76 U/l下降至12周时的36 U/l(P <0.001)。HBsAg水平均没有显著变化,提示该药对HBsAg作用有限。
Phase 2b 期临床试验是在HBV/HDV 合并感染者中进行的,在 2018 美国肝病学会(AASLD)年会上公布了部分研究结果,Myrcludex B单药治疗并未观察到 HBsAg 出现明显变化。(更多数据详情可查看文章:AASLD2018:Myrcludex B与PEG-IFNα联用具有治愈慢性 HDV 和 HBV感染潜力)
4.衣壳抑制剂
乙型肝炎病毒(HBV)衣壳蛋白装配抑制剂以病毒的衣壳蛋白装配(Capsid assembly)为靶点,对衣壳蛋白装配的阻断或加快衣壳蛋白降解都会干扰衣壳装配过程,从而影响病毒复制。全球目前在研的HBV衣壳蛋白抑制剂从化合物结构上主要分为两大类:异芳基—二氢嘧啶(heteroaryldihydropyrimidines 、HAPs)和磺酰胺类(phenylpropenamides、PPAs),而我国上海挚盟医药科技公司在2018年美国肝病年会(AASLD2018)上发布了具有全新骨架的吡唑类化合物CB-HBV-001。
此类在研药物较多,并且也有不少已经进入人体临床试验阶段。
GLS4(甲磺酸莫非赛定)
GLS4是由我国东阳光药开发的一款HBV衣壳蛋白装配抑制剂,属于异芳基—二氢嘧啶类化合物,前期1b期研究结果显示28天GLS4/RTV(利托那韦)联合治疗可有效抑制HBV DNA血清学水平。目前已经进行IIa期临床试验,并在2018AASLD上公布了完成20周治疗的结果。
20例慢性HBV感染患者分别接受GLS4 120mg BID或TID(队列A或B)联合RTV治疗,每队列10例患者。
GLS4对HBeAg阳性和阴性患者的HBV DNA定量均有明显的抑制作用。根据已有数据,队列A和队列B的HBV DNA定量平均最大降幅分别为3.28(1.48~5.58)和4.40(1.51~6.09)log10IU/mL。3例患者的HBV DNA定量达到定量下限以下(LLOQ= 20IU /mL)。队列A和队列B HBsAg定量在治疗期间平均最大降幅分别为0.20(0.01~0.77)和0.44 (0.00~1.30) log10IU/mL。队列A和队列B HBeAg定量平均最大降幅分别为0.57(0.00~1.49)和1.06 (0.14~2.07) log10IU/mL。此外,研究发现GLS4也能显著降低HBcrAg和HBV RNA的血清水平。
同时,GLS4/RTV在慢性乙肝患者中耐受良好,大部分不良事件(AEs)均较轻,且无剂量限制毒性。
JNJ-56136379(JNJ-6379)
JNJ-6379 是一款由 Johnson 旗下杨森(Janssen)公司研发的HBV衣壳蛋白装配抑制剂,属于磺酰胺类化合物,在 2018 美国肝病学会(AASLD)年会上公布的1b 期研究数据显示,在HBeAg阴性和阳性初治慢乙肝患者中,28天的JNJ-6379 用药安全性,耐受性良好,表现出剂量依赖性PK,并且在评估的所有4个剂量组(25, 75,150 和 250mg )中均产生有效的抗病毒活性。但对 HBsAg 或 HBeAg 似乎无明显作用。
在2018年全球肝炎峰会(Global Hepatitis Summit 2018)上公布的部分2a 期临床研究结果显示,在用药后的第29天,在所有3个治疗组中均观察到 HBV DNA 和 HBV RNA 从基线显著降低,但没有观察到HBsAg有显著变化。重复给药后,药物暴露以剂量依赖性方式增加,耐受性和安全性良好。
目前该药已经在进行2期临床研究。
JNJ-64530440(JNJ-0440)
JNJ-0440 也是一款由 Johnson 旗下杨森( Janssen)公司研发的HBV衣壳蛋白装配抑制剂,属于磺酰胺类化合物。在 2018 美国肝病学会(AASLD)年会上公布的体外研究数据显示, JNJ-0440 可在稳定的HBV复制细胞系和HBV感染的PHH中抑制HBV复制(干扰HBV衣壳组装),在广泛的基因型A-H临床分离株中具有活性,并阻断PHH中cccDNA库的形成。
在 2018 美国肝病学会(AASLD)年会上公布的1期研究数据显示,单剂量JNJ-0440高达900mg安全性依然良好并且在健康受试者中耐受性良好。 PK与剂量成比例,达到预期具有抗病毒活性的浓度,并且支持每日一次口服给药。在健康受试者的进一步单剂量和多剂量升级研究,以及本研究中HBV感染患者的抗病毒活性评估正在进行或计划中。
ABI-H0731
ABI-H0731 是 Assembly 公司在研的一款新型核心蛋白变构调节剂(CpAM),能选择性的靶向病毒核心蛋白,该 HBV 蛋白涉及 HBV 生命周期中多个步骤包括 cccDNA 的形成。
已完成的 Phase1 期研究结果表明,ABI-H0731单药治疗在入组研究的慢乙肝患者中耐受性普遍良好,没有严重的不良反应,没有显著的药物相关药物依赖或因治疗出现的实验室异常。4个剂量组(100, 200, 300 或400 mg)中每组的中位数 - 最大(范围)log10IU / mL HBV DNA下降范围从 100 mgQD 的1.5(0.7-3.6)到 300 mg QD 的2.7(0.8-4.0),100mg 和 300mg 队列 HBeAg 阳性/阴性受试者的中位 log10 IU / mL分别下降1.4 / 2.2 和 3.0 / 2.5。在 300mg 和 400mg 队列中观察到相似的最大下降幅度(~4 log10 IU/mL) 。研究还观察到 HBeAg 阳性受试者的 HBV RNA 下降与观察到的HBV DNA下降平行。
目前公司已启动了两项该药 Phase 2a 期临床试验,研究将会评估该药单药或跟核苷(酸)类似物联合用药对病毒的效果以及安全性和耐受性,监测的标志物除了常规的HBV DNA 外还包括HBV S抗原(HBsAg)和HBV E抗原(HBeAg)。
ABI-H0731 在今年7月底获得 FDA 授予的快速通道认定。
ABI-H2158(ABI-2158)
ABI-H2158 是 Assembly 公司开发用于慢乙肝治疗的一款在研二代核心蛋白变构调节剂(CpAM)。
Assembly 公司 HBV 项目首席科学家 Richard Colonno 博士在一个专注乙肝领域的会议上公布该药时评论到“我们的HBV项目目标是通过使用我们的直接作用CpAMs靶向必须的病毒核心蛋白从而实现提高慢乙肝治愈率,CpAMs 已经在体外研究中显示能抑制病毒复制以及更重要的步骤——跟病毒耐药相关的cccDNA形成!在其他的体外研究中,我们的下一代临床候选产品 ABI-H2158,显示出具有增强的效力,同时保持跟我们的第一个临床候选产品ABI-H0731相同的有利的药物样(DMPK)特征。”
目前该药已经开始进行Phase 1a期临床试验。
AB-423
AB-423 是 Arbutus 公司研发的一款核心蛋白变构调节剂(CpAM)。前期研究结果表明,在HepAD38细胞系中,AB-423 可阻断 pgRNA 衣壳化和cccDNA形成。在HBV细胞培养模型进行的抗病毒效力和细胞毒性评估中,AB-423 对HBV复制表现出有效抑制作用,在跟核苷(酸)类似物或RNAi制剂联合用药中表现出有利的抗病毒活性。目前该药已经着手在健康志愿者中进行 Phase 1期临床试验。
AB-506
AB-506 是 Arbutus 公司研发的一款二代核心蛋白变构调节剂(CpAM)。体外联合研究表明AB-506与批准的NA或ARB-1467的体外联合在降低HBV rcDNA和HBsAg水平上有累积至中度协同作用,对细胞活力没有显著影响。
在水动力注射(HDI)HBV小鼠模型中,AB-506 + AB-452,AB-506 + TDF 联用表现出强烈的抗病毒活性,相对于赋形剂对血清 HBV DNA 的降低平均值分别为1.4,1.9 和 2.2 log,而三联疗法的组合对血清 HBV DNA 的降低影响更大,相对于赋形剂对照组为降低2.8 log。
目前该药已经在健康志愿者和慢乙肝患者中进行 Phase 1a/1b期临床试验。
RG7907
RG7907 是 Roche 公司研发的一款核心蛋白变构调节剂(CpAM)。目前暂时未见有关该药的更多公开信息。
QL-0A6a
QL-0A6a 是齐鲁药业研发的一款衣壳抑制剂,在HepG.2 .15 细胞实验中,低浓度的QL-0A6A可干扰HBV的衣壳装配。QL-0A6A对不同基因型的HBV均有抑制作用,与核苷(酸)类似物联用也表现出对HBV的复制呈现联合抑制作用。QL-0A6A对核苷(酸)类似物耐药的HBV突变体也具有活性。在HDI模型中QL-0A6A对HBV复制的抑制作用呈浓度依赖性。在FRG小鼠模型中,QL-0A6A使血浆 HBV DNA 最多下降了3 .71 log,肝内HBV DNA也明显降低,通过qPCR 和Southern blot 检测发现。在FRG研究中QL-0A6A的抗HBV活性比替诺福韦要高。
QL-007
QL-007 也是齐鲁药业研发的一款衣壳抑制剂,据CDE数据显示该药现已进入I期临床研究。目前暂时未见有关该药的更多公开信息。
GLP-26
GLP-26 是美国埃默里大学(Emory University)研发的一款衣壳抑制剂类,之前的EASL上关于GLP-26的临床前研究显示其良好的抗病毒效用,以及其与现有抗病毒药物的联合用药效果,现在仍处于临床前研究阶段。目前暂时未见有关该药的更多公开信息。
EP-027367
EP-027367 是 Enanta 公司研发的一款新型衣壳抑制剂。在今年的欧洲肝病学会年会上上发布的研究结果显示,体外试验中EP-027367可通过调节HBV衣壳装配并阻断病毒pgRNA衣壳化。在HepG2.2.15,HepAD38和HepDE19细胞中分别以EC 50s 20,24和40nM 抑制 HBV rcDNA 产生作用。对HBV基因型A-H均有活性,效力范围从7到50nM,并且不受已知核苷(酸)类似物耐药性变异的影响。
EP-027367与其他HBV抑制剂的联合使用在体外显示出增效和协同抗病毒活性。此外,EP-027367可以以亚微摩尔的浓度通过抑制新cccDNA的形成来防止易感细胞系的从头感染。在人肝脏嵌合体小鼠模型中,以 50,100和200mg / kg BID 口服给药28天的EP-027367分别使HBV DNA水平从基线分别降低2.2 , 2.7 和 3.0 log。
目前该药仍处在临床前研究阶段。
5.HBsAg抑制剂(HBsAgInhibitors)
HBsAg 抑制剂主要通过干扰乙肝表面抗原的产生来实现抗乙肝病毒目的。该类药物目前的代表药物是核酸聚合物(NAPs)类药物,代表药物有 REP 2139 和 REP 2165,这两款药物均为加拿大公司 Replicor 研发,目前已经在Phase II 期临床研究。目前的研究发现NAPs 具有清除循环中乙型肝炎表面抗原(HBsAg)的独特能力,其通过阻止HBsAg 从感染的肝细胞分泌,潜在地干扰亚病毒颗粒的释放。此外,还有 Roche 公司的RO7020322(RG7834) 。
REP 2139 & REP 2165
已公布的2期临床研究( REP 301 研究,NCT02233075) 显示 REP 2139 跟 pegIFN 联合用药使 5/12名慢乙肝患者获得功能性控制,并在撤掉所有抗病毒药物后5名患者的HBV维持着功能性清除(HBsAg < LLOQ, HBV DNA < LLOQ)。
REP 301研究的24周随访结束时,5名实现HBV感染功能性控制的患者仍然有4名持续维持着功能性控制。第五位患者的 HBV感染仍然得到很好的控制(HBV DNA <LLOQ)。而随后针对这些获得功能性控制患者进行的为期三年的补充随访研究(REP 301-LTF,NCT02876419)目前正在进行,该研究主要观察 REP 301 研究中实现 HBV感染功能性清除的长期稳定性。在随访至1.5年的时间节点时,其中5名实现HBV感染功能性控制的患者,仍然有4名持续维持着功能性控制。
随后进行的REP 401研究(NCT02565719)主要是评估 REP 2139-Mg(临床)或 REP 2165-Mg 联合富马酸替诺福韦二吡呋酯(TDF)和聚乙二醇化干扰素α-2a(pegIFN)治疗慢性HBeAg阴性HBV感染的安全性和有效性。在该研究中40名患者随机(1:1)进入实验组(TDF 48周,pegIFN 和 REP 2139-Mg / REP 2165-Mg)或对照组(48周TDF +pegIFN)。24 周治疗后,由于HBsAg 反应较差,所有对照组患者均进行了48周的实验治疗。
伴随 REP2139-Mg / REP 2165-Mg 暴露,在38/40例患者中观察到转氨酶升高。这些升高均自行缓解且无症状并与治疗期间血清 HBsAg 的降低相关。实验治疗期间,HBsAg减少如下:在36/40患者中从基线开始> 1log,在28/40患者中<1IU / mL,在24/40患者中<0.05IU / mL。
HBsAg 血清学转换(> 10 mIU / mL)发生在24/40例患者中,12/40患者的滴度> 1000 mIU / mL,10/40患者的滴度> 10,000 mIU / mL 。在完成治疗且≤24周随访的患者中,HBV感染的功能性控制目前持续维持着。
对于≥24周随访的功能性控制患者,20/26 患者 HBsAg 目前≤10IU / mL,14/26患者≤0.05IU / mL(LLOQ)。ALT 和 AST 在25/26例患者中正常化(<50 U / L)。此外,目前在 21/26 例患者中观察到治疗结束时肝脏硬度中位数下降,16/26例患者正常(<7 kPa),肝功能正常化和肝硬化中位数下降也表明这些患者纤维化的逆转。
对于研究中观察到一小部分患者在 REP 2139 治疗过程中的 HBsAg 降低只有非常小的滴度(< 1 log),研究人员后续进行的研究发现乙肝病毒完整的前S / S ORF氨基酸序列对REP 2139-Ca 治疗的反应没有直接影响。
RG7834
RG7834 是一款由Roche公司研发的用于慢乙肝治疗的新药,属于HBsAg抑制剂类药物。不过据说因为药物的神经毒性公司已经放弃了改款药物的研究。
2017年发表的研究结果显示,在HBV自然感染试验和HBV感染的尿激酶型纤溶酶原激活因子/重症联合免疫缺陷人源化小鼠模型中,单用RG7834或RG7834和恩替卡韦联合应用研究显示。核苷(酸)类似物可以有效降低病毒血清学水平,但不能有效降低HBV抗原表达,而RG7834的作用特征与核苷(酸)类似物不同,除了可以降低病毒水平,还可以显着降低包括HBsAg等病毒蛋白的水平。表达水平分析表明,应用RG7834治疗可以使HBV mRNAs水平快速选择性下降。
在HBV感染的人源化小鼠模型中,恩替卡韦治疗对HBsAg水平无显着影响,与之相比,RG7834口服治疗可以使HBsAg水平平均下降1.09 log;此外,联合应用RG7834、恩替卡韦和聚乙二醇干扰素-α,可以使人源化小鼠的HBV DNA和HBsAg水平均显着下降。
6.反义分子(AntisenseMolecules)
此类药物通过与病毒mRNA结合阻止其转变为病毒蛋白从而抑制病毒复制。跟RNAi疗法药物作用于乙肝病毒的作用机理类似。代表药物有 Ionis 跟 GSK 开发的 IONIS-HBV-LRx(GSK33389404),IONIS-HBVRx(GSK3228836)。美国斯克利普斯研究所(TSRI)在《Journal of Hepatology 》上曾发表过一篇有关反义寡核苷酸用于乙肝的研究[2]。
IONIS-HBV-LRx(GSK33389404)
IONIS-HBV-LRx 即是以前的 IONIS-GSK6-LRx,是 Ionis 公司跟 GSK公司合作研发的一款使用配体共轭反义(LICA)技术的2.0代产品药物,设计用于降低跟乙肝病毒感染和复制相关的病毒蛋白,包括乙肝表面抗原(HBsAg)。IONIS-HBV-LRx 是使用 Ionis 公司创新性技术配体共轭反义(LICA)技术的首款抗病毒感染药物,其旨在通过增强靶向组织的药物递送来增加药物效力。
在2017年3月份,Ionis 公司合作伙伴 GSK 已经启动了在研新药 IONIS-HBV-LRx 的Phase 2 期临床研究,该研究是在未经治的慢乙肝患者中进行的。而 Ionis 公司也曾于2016年1月份完成了 IONIS-HBV-LRx 的 Phase 1期临床试验,该1期临床主要评估单剂量和多剂量 IONIS-HBV-LRx 在健康志愿者中的安全性、耐受性和药代动力学。
目前未见有关该药的详细试验数据公布。
IONIS-HBVRx(GSK3228836)
IONIS-HBVRx 也是一种反义药物,是配体共轭反义(LICA)技术的2.0代产品,设计用于降低跟乙肝病毒感染和复制相关的病毒蛋白,包括乙肝表面抗原(HBsAg)。
在2017年3月份,Ionis 公司合作伙伴GSK 已经启动了在研新药 IONIS-HBVRx 的 Phase 2 期临床研究,该研究是在未经治的慢乙肝患者中进行的。而 Ionis 公司也曾于2016年1月份完成了 IONIS-HBVRx 的 Phase 1期临床试验,该1期临床主要评估单剂量和多剂量IONIS-HBVRx 在健康志愿者中的安全性、耐受性和药代动力学。
目前未见有关该药的详细试验数据公布。
7.核糖核酸酶H抑制剂(Ribonuclease H Inhibitors)
核糖核酸酶H是乙肝病毒复制过程中一种重要的酶,是乙肝病毒多聚酶基因编码的4个功能域之一,该蛋白具有降解DNA-RNA杂交体中RNA的活性,在HBV 逆转录过程中发挥重要作用。针对该酶是开发治疗乙肝药物的一个有吸引力的靶点,圣路易斯大学研究人员曾在Antiviral Research杂志中报告了 RNaseH 酶的第一次完整的生化分析研究结果,这是是筛选新药物的关键。此后,他们还在 Antimicrobial Agents and Chemotherapy杂志上报道了 RNaseH 抑制剂跟现有主要的抗乙肝病毒药物联合用药的研究结果,表明该药跟现有药物联合用药具有协同作用。
该类药物目前查到的较少,Lomonosova E 等在 Antiviral Res 杂志上报道了α-羟托吡酮类化合物用于抑制乙肝病毒复制的体外研究结果(Efficacy and cytotoxicity in cell culture ofnovel α-hydroxytropoloneinhibitors of Hepatitis B virus ribonuclease H.)。还有 Arbutus 公司也有一款处在临床前研究阶段针对核糖核酸酶H的在研乙肝新药ARB-452,不过目前还未见更多详细试验数据公布。
8.治疗性乙肝疫苗
治疗性疫苗是指在已感染病原微生物或已患有某些疾病的机体中,通过诱导特异性的免疫应答,达到治疗或防止疾病恶化的天然、人工合成或用基因重组技术表达的产品或制品属于特异性免主动疫疗法。治疗性乙肝疫苗是针对慢性乙型肝炎患者或HBV 携带者,通过不同途径呈递乙肝抗原,打破机体的免疫耐受,有效诱导免疫应答,达到清除乙肝病毒目的。治疗性乙肝疫苗主要分为基因工程蛋白疫苗、DNA疫苗、DC疫苗等。
目前全球在研的治疗性乙肝疫苗有较多,其中代表性的有 AiCuris 的 AIC 649,Inovio的INO-1800,Ichor 的 HB-110,Transgene 的 TG1050,Altimmune 的 HepTcell,TomegaVax 的 HBV (TomegaVax),GeoVax Labs 的 HBV,Vical 的 VR-CHB01。
AIC 649
AIC 649 是一款 AiCuris 公司研发的一种灭活的羊副痘病毒(iPPVO)颗粒制剂,具有独特的免疫学活性包括调节细胞因子释放和激活T细胞应答。早起研究显示,小鼠经静脉给予单剂量 AIC-649 刺激了细胞因子的释放,包括干扰素γ和α、TNF-α、单核细胞趋化蛋白1 (MCP-1) 及白介素-6 (IL-6)。此外,在转基因小鼠模型中,AIC-649 降低 HBV 病毒载量的作用与替诺福韦相仿。使用这一策略的更多证据来自替代 HBV 的旱獭肝炎病毒(WHV),感染旱獭使用 AIC-649 后,WHV 表面抗原水平明显降低。
已公布的部分 Phase1 期单递增剂量临床试验结果显示 AIC649安全性和耐受性良好,没有剂量限制性毒性,并且最大耐受剂量未达到施用的最高剂量。
INO-1800
INO-1800是Inovio公司研发的一种治疗性乙肝疫苗,临床前研究数据表明,该疫苗能够产生强大的T细胞和抗体反应,并在小鼠模型中引发了针对性的肝细胞清除。已公布的Phase 1 期临床结果显示其具有良好的安全性,耐受性并且产生病毒特异性T细胞,包括CD8 +杀伤T细胞,达到 Phase1 期临床研究的目标。
目前该疫苗仍在继续进行临床试验。
HB-110
mHB-110 是一款新型 DNA 疫苗,前期在BALB/c 或 HBV转基因小鼠研究中,HB-110具有免疫原性并检测到T细胞和抗体应答产生。
而在韩国慢乙肝患者中进行的Phase 1期临床研究结果显示,mHB-110 诱导的T细胞核抗体应答比在小鼠中的应答更高。跟阿德福韦酯联用的慢乙肝患者中没有观察到不良反应事件。HBV特异性T细胞应答在中高剂量组的部分慢乙肝患者中出现,对ALT正常化转归和 HBeAg 血清学转换也表现出积极作用。接受高剂量 HB-110 用药的一例慢乙肝患者在疫苗接种期间出现 HBeAg 血清学转换,可能跟疫苗诱导的T细胞应答但没有ALT升高有关。 HB-110在慢乙肝患者中安全性耐受性良好,相较于在动物模型中的结果,HB-110 在韩国患者中诱导的HBV 特异性T细胞应答和HBeAg 血清学转换要较在白人人中弱。
目前该款疫苗暂未有更进一步的研发进展信息公布。
JNJ-64300535
JNJ-64300535 是一款 Janssen 公司研发的用于慢乙肝治疗的研究性DNA疫苗,该款疫苗采用TriGrid药物递送系统进行药物递送。目前该款治疗性乙肝疫苗已经开始进行人体试验,并于今年6月完成人体用药工作,
目前该款疫苗暂未有更多临床研究信息公布。
TG1050
TG1050 是Transgene 公司研发的一款基于腺病毒的治疗性乙肝疫苗,能编码一种独特融合蛋白的复制缺陷型腺病毒5型,该融合蛋白是由截短的HBV核心蛋白、修饰的HBV聚合酶和两个HBV包膜区组成。
在HBV初始感染和HBV持续感染的小鼠模型中,注射TG1050既诱导脾脏的又诱导肝内的功能性T淋巴细胞产生,并释放细胞因子和具有细胞毒作用,同时循环血中病毒(活跃或复制的)指标显著下降。
在使用NUC控制良好的慢乙肝患者中完成的phase 1b 期研究显示,TG1050 耐受性良好;主要药物相关不良事件(AEs)为1级或2级注射部位反应,没有ALT升高,没有SAE,也没有观察到免疫相关AE的迹象。患者接种疫苗后出现HBV特异性T细胞应答,多名患者出现至少1种甚至多种针对疫苗抗原的应答。试验结果证实了TG1050的免疫原性以及其破坏CHB免疫耐受的能力,同时改善了对多种HBV抗原(包括ENV)的T细胞应答。
目前该治疗性疫苗已获得国内药监部门批准进行临床试验,国内名称为治疗用乙型肝炎腺病毒注射液(T101)。
HepTcell
HepTcell 是 Altimmune 公司开发的一款产品,已进行的 Phase 1b 期研究结果表明,在所有测试剂量下 HepTCell 都具有良好的耐受性,但非盲T细胞免疫原性(unblinded T-cell immunogenicity)结果不能确定。根据研究方案,研究将对受试者进行完整的6个月随访,不过从官方发布的结果看他们对该款疫苗的前景似乎不太乐观。
HBV (TomegaVax)
HBV(TomegaVax)是TomegaVax公司的产品,目前还处在临床前研究阶段,未见更多详细信息公布。
VR-CHB01
VR-CHB01 是Vical公司开发的一款产品,目前还处在临床前研究阶段,未见更多详细信息公布。
Nasvac
Nasvac 是古巴基因工程与生物技术中心(CIGB)研发的一款治疗性乙肝疫苗,含乙肝表面抗原(HBsAg) 和乙肝核心抗原(HBcAg)。
首批用药(phase I期临床)的6名慢乙肝患者停药5年的随访结果显示,其中3名HBeAg阳性患者的HBeAg已经消失,2名患者出现HBeAg血清学转换出现anti-HBeAg。6名患者中有5名患者的病毒载量下降到检测下限,其中有2名患者出现 HBsAg 血清学转换。ALT升高到2倍正常值上限以上的仅在HBeAg阳性患者中观察到且跟HBeAg消失相关。在随访期间,所有患者均未出现肝硬化或中度肝纤维化(通过Fibroscan评估<7.8 KPa)。由于随访期间肝功能持续正常以及没有出现达到需要治疗的标准,因此不需要任何其他药物干预。
法国生物科技公司 ABIVAX 曾拿着该款治疗性乙肝疫苗在亚太地区的8个国家和地区(澳大利亚,新西兰,台湾,香港,泰国,新加坡,韩国)进行了Phase IIb/III 期临床试验。不过很遗憾,试验进行至中途由于病毒逃逸导致患者退出率过高,研究的首要研究终点无法实现,公司经研究分析后放弃了该款治疗性乙肝疫苗的临床研发。
最近的2018AASLD上,研究人员发表了一项该药物的改良版在日本进行的临床试验结果:23名使用NUCs 的HBV患者(平均ALT:19(16-27)U / L,平均HBsAg:436(229-1853) IU / mL))和31名未使用NUCs的HBV患者(平均ALT:21(16-27)U / L,平均HBsAg:1370(101-3469)IU / mL)),每2周仅通过鼻腔给药 10次。研究评估治疗结束时(EOT)和EOT后6个月的数据。
截止研究结果发表,已有12名wNUC患者和5名w / oNUC患者完成6个月随访。在11/12名(91.7%)wNUC患者和5/5名(100%)w / oNUC患者中观察到HBsAg的减少。wNUCs 患者的 HBsAg 减少量为23.5%(平均值),w / oNUCs患者为44.1%。在12名(25%)wNUC患者中有3名检测到HBsAg抗体(抗-HBs),在5名(40%)w / oNUC患者中2名检测到抗体。据最新数据显示2名w /oNUCs患者和1名患者wNUCs患者已经实现了 HBsAg 的清除和获得抗HBs 且HBV-DNA持续阴转。
目前该款疫苗的临床研究仍在继续。
9.靶向先天免疫防御途径(InnateImmune Defense Pathway)药物
该类药物通过激活先天免疫应答达到抗病毒作用,代表药物有 Inarigivir (SB9200)、GS9688、RG7854和JNJ‐4964(AL‐034/TQ‐A3334)等。
RG7795
RG7795(以前的ANA773)是一种抗病毒药物候选药物,是一种研究性可口服用药的小分子化合物,通过肝炎中的Toll样受体7(TLR7)途径起作用,是isatoribine前药,Anadys Pharmaceuticals 在 2011 年被 Roche 收购时该药正在开发中。 TLR7激动剂引起抗病毒细胞因子的产生和免疫细胞的活化/成熟,具有增强免疫应答的潜力。
临床前数据显示,ANA773的活性代谢物通过诱导细胞因子分泌,肿瘤细胞的细胞溶解和增强的抗体依赖性细胞毒性(ADCC)来促进自然杀伤(NK)细胞介导的抗肿瘤反应。
至2015年已进入II期临床试验,不过目前未见更多公开信息。
RG7854
RG7854 是 Roche 公司的一款Toll样受体7(TLR7)激动剂,目前处在Phase I期临床,不过目前未见更多公开信息。
GS9688
GS9688 是Gilead公司的一款选择性小分子toll样受体8(TLR8)激动剂,在慢乙肝土拨鼠模型中, GS-9688 诱导实现了更长时间的血清 WHV DNA 和 WHsAg 抑制, 减少肝内cccDNA并诱导产生可检测水平的anti-WHsAg 。
已公布在健康志愿者中进行的1a期研究结果显示,口服 GS-9688 诱导血清免疫调节(如IL-12p70)和抗病毒(如IFN-g和TNF-α)细胞因子,以及多种趋化因子和急性期蛋白水平呈现剂量依赖性增加。细胞因子和趋化因子水平在给药后2-4小时达到峰值,并在给药后24小时恢复到接近基线。急性期蛋白C-反应蛋白(CRP)和血清淀粉样蛋白A(SAA)的诱导显示出较慢的动力学,在给药后24小时测量到最高水平。除了这些可溶性因子外,口服GS-9688还增加了NK和粘膜相关不变T(MAIT)细胞表达早期活化标记物CD69 的表达频率。
目前该药的临床研究仍在继续。
Inarigivir (SB9200)
Inarigivir(SB9200) 是一款由 SpringBank Pharmaceuticals 公司开发一款新药,是一种小分子二核苷酸口服有效的HBV抗病毒药物,具有直接作用和免疫调节活性,刺激宿主固有的抗病毒应答。与细胞质模式识别受体视黄酸诱导基因(RIG-I)结合以增强RIG-I与HBV前基因组RNA的5'-ε区域的结合,通过置换 HBV Pol 或阻止 pgRNA 衣壳化和复制复合物的组装。
目前该药已经进行 Phase 2 期临床研究,低剂量组 25mg 、 50mg剂量组显示该药用药12周后,转换为每日300mg的替诺福韦(TDF)再用药12周能使HBV DNA 、HBsAg 和HBV RNA 显著降低甚至低于检测下限,部分患者出现抗-HBs抗体及治疗性ALT升高,研究中还观察到HBeAg阴性患者比HBeAg阳性患者具有更强的抗病毒应答。研究过程中inarigivir 的耐受性良好,没有观察到严重不良反应事件。因治疗而出现的不良反应事件均为轻度至中度,没有观察到干扰素样副作用或临床或3级以上的生化学事件。
Gilead 公司正在实施 inarigivir 联合替诺福韦艾拉酚胺(TAF)的 Phase2 期临床研究,该研究是在未经治的慢乙肝患者中进行的。该研究的新第二队列将评估200mg inarigivir与替诺福韦艾拉酚胺共同给药,接受 200mg 剂量的 inarigivir 安全性的独立监管评估。此外,还增加了一个新的第三个队列来检查 100mg 的 inarigivir 用于目前已用核苷(酸)类似物(“Nuc抑制”群体)治疗的慢乙肝患者的效用。
待该研究全部完成后,Spring Bank 将会在 2019 年初将 inarigivir 开发推进到多个计划的 Phase 2b / 3 期研究。计划的临床试验包括:1)inarigivir单药治疗作为Nuc抑制患者(“抑制和休克”)的附加药物;2)给停止Nuc治疗的患者(”停止和休克“)予inarigivir 单药治疗。
另外,SpringBank除将 inarigivir 推进到 Phase 2b / 3 期计划之外,还计划在未经治的慢乙肝患者中开展一项关于 SB 9225 的 Phase 2b 期临床试验,SB 9225是一种由inarigivir 和替诺福韦(TDF)混合剂量组成的药物。公司还将继续探索合作,包括针对HBsAg 的 siRNA化合物,以及其他抗病毒和免疫调节机制药物联合用药研究合作。
JNJ‐4964(AL‐034/TQ‐A3334)
JNJ‐4964是 Janssen 公司研发的一款用于治疗慢性乙型肝炎(CHB)的口服Toll样受体7(TLR7)激动剂,可能在恢复对HBV的免疫应答中起重要作用。据一项已发表的在AAV / HBV动物模型中评估JNJ-4964恢复抗HBV免疫应答能力的临床前研究结果显示,JNJ-4964 在治疗12周的 AAV /HBV 小鼠中显示出有效的抗HBV活性。所有动物在开始治疗14天后都检测不到 HBV-DNA 和 HBsAg ,且无 ALT 升高。在随访结束前未观察到HBV DNA和HBsAg的反弹。在治疗开始后21天至随访结束时观察到血清学转化(HBsAg低于检测极限并具有可检测的抗-HBsAg抗体)。
在随访结束时,肝脏 HBV-DNA 和 HBV-RNA 水平分别下降了 1.17 log10 和0.7log10。在第16周(最后一次给药后4周),一半动物的肝脏中HBcAg表达下降,HBsAg检测不到。在治疗结束和随访结束时观察到可检测水平的针对表面抗原的T细胞和B细胞应答,表明在JNJ-4964处理的小鼠中存在持续的T和B细胞免疫。
10.宿主靶向途径(HostActing Pathway)药物:诱导程序性细胞死亡(细胞凋亡)的化合物
APG-1387
APG-1387是我国领先的原创新药研发公司亚盛医药自主设计开发的、具有全球知识产权的新一代凋亡蛋白抑制因子(IAP)高效特异性抑制剂,主要通过模拟内源性Smac分子降解IAPs来诱导和加速细胞凋亡的进程。
由南方医院肝病中心张小勇教授课题组完成的临床前研究发现,慢性乙肝患者肝内IAPs分子表达上调,导致HBV感染的肝细胞发生免疫逃避,不能被特异性T细胞杀伤。APG-1387治疗可有效抑制肝细胞中的IAPs表达,促进病毒特异性T细胞介导的HBV DNA和HBV表面抗原的消除,从而治愈慢性HBV感染。IAP抑制剂用于治疗乙肝病毒感染的优势在于,依靠特异性T细胞的识别能力,能优先杀死感染细胞而不影响健康细胞。
该药目前已获得食品药品监督管理局(CFDA)核发的新型小分子IAP抑制剂APG-1387针对乙型肝炎适应症的新药临床批件。
CRV 431 (CPI 431-32)
CRV431是 ContraVir 公司研发的一款环孢菌素A(CsA)的非免疫抑制类似物(亲环蛋白抑制剂),其主要生化作用是抑制在蛋白质折叠中起关键作用的亲环蛋白异构酶。其他病毒如HIV-1和HCV同样使用亲环蛋白进行复制。 CRV431在实验模型中通过减少多种感染标志物(包括HBV DNA,HBsAg,HBeAg和细胞对HBV的摄取)显示了其有望成为补充当前乙型肝炎治疗的潜力。已有研究表明,CRV431还具有抗纤维化活性,可以进一步抑制患者肝脏疾病的进展,此外,在NASH鼠模型中,CRV431减少了动物模型中纤维化的进展,并且还减少了肝细胞癌(HCC)模型中肝肿瘤的数量和缩小了肿瘤的大小。
该药已经进行 Phase1 期临床研究,公布的第一队列数据显示,CRV431在安全性和耐受性方面均良好。第二队列观察到的研究结果跟第一队列的结果相一致,显示其安全性和耐受性均良好,并在药代动力学(PK)上的表现跟在健康成年志愿者中的单剂量用药的表现相一致。
CRV431的Phase 1期临床研究第一部分将评估CRV431 在健康志愿者中单剂量给药的安全性,耐受性和药代动力学(PK)特征。研究的第二部分将是在稳定的HBV患者中使用CRV431联合Viread®的单剂量药物 - 药物相互作用初步研究。研究的第三部分将评估稳定HBV患者使用 CRV431 与 Viread® 联合用药的安全性,耐受性,PK和抗病毒效用的初步信号以及对临床相关生物标志物的初步影响。
NJK14047
NJK14047是一种选择性的p38 MAPK抑制剂,是韩国庆熙大学研究人员合成的一系列联苯酰胺类药物之一。测试研究结果显示,NJK14047可有效地抑制HBV基因转染细胞和HBV感染的表达牛磺胆酸钠共同转运多肽人肝癌细胞的HBV抗原和HBV颗粒分泌。
此外,研究人员还发现NJK14047用药后HBV携带细胞中HBV的前基因组RNA(pgRNA)和共价闭合环状DNA(cccDNA)均出现显著降低,表明其具有抑制HBV复制的能力。
目前暂时没有该药物的进一步研究信息。
11.基因编辑类
基因编辑是指对DNA核苷酸序列进行定点修饰(删除和插入等操作)的一项技术,该技术可精确剪断靶DNA片段并插入新的基因片段,既可以模拟基因的自然突变,又可以修改编辑原有基因组,真正实现“编辑基因”。目前国内外使用基因编辑技术进行的非人体研究非常多,已将该技术进行临床试验的公开研究屈指可数,并且这些公开的临床试验都不是慢乙肝治疗领域,据Clinicaltrials.gov登记在册的共有10项临床试验,其中有1项已经终止研究,余下9项研究中有6项来自中国。
而目前暂时未见公开报道使用该技术用于慢乙肝治疗的临床试验研究。据悉吉列德科学公司已经进军基因编辑用于慢乙肝治疗研究领域,国内有公司还有望引进吉列德的该技术在国内进行临床研究。
12.其它类
GC1102
GC1102 是一款韩国 Green Cross 公司研发的单克隆抗体(重组人乙型肝炎免疫球蛋白)药物,该药有望通过降低血液HBsAg水平来改善持续的病毒学应答,从而提高治疗效果。
已发表的研究结果显示,血清HBsAg≤1,000IU/ mL的慢乙肝患者单剂量或多剂量给药(80,000 IU,120,000 IU,180,000 IU和240,000 IU)耐受性和安全性良好,未发生剂量限制性毒性。受试对象每次给药者HBsAg滴度均显著下降,然而停药28天后HBsAg滴度开始反弹,经历HBsAg消失的受试者除外。
目前该药已经进入Phase2/3期临床。
EYP001
EYP001是一款 Enyo Pharma 公司研发的类法尼醇X受体(farnesoidX receptor,FXR)激动剂。体外研究结果显示 EYP001 能抑制HBV颗粒的释放,单药用药能抑制病毒蛋白(HBsAg 和 HBeAg)产生,降低cccDNA和pgRNA。
已经完成的 1a期临床结果显示该药安全性和耐受性良好,没有治疗相关的停药或严重的不良事件(SAE)。
在Ib期研究中,慢乙肝患者单用该药或跟聚乙二醇干扰素Peg-IFNα2a联合用药,每日一次口服治疗4周。EYP001 安全性和耐受性良好,最常见的治疗期间发生的不良事件(TEAE)为胃肠道失调。这些TEAE均为短暂性,程度为轻度至中度。在所有EYP001每日一次(QD)剂量组中,只有10%的患者出现轻度自限性瘙痒,没有观察到LDL-C水平升高。没有观察到脱靶效应,没有发生严重不良反应或严重的意料之外的严重不良反应。EYP001 单药或联合用药在 HBeAg 阴性和HBeAg 阳性慢乙肝患者中,对几个乙肝病毒参数表现出一致的抗病毒作用,包括:HBV病毒载量、HBV RNA、HBcrAg、HBsAg。
目前该药已经进入II期临床开发。
此外,一些新兴的热门治疗技术或药物也被应用于慢乙肝的临床前/临床研究,如CAR-T免疫疗法、PD-1/L1抑制剂等,并且也有部分相应的研究/临床数据公布,但观察到的临床效果有限,此处不展开,感兴趣的可以去搜索相关文献了解。
讨论(个人观点)
慢乙肝治疗已经由干扰素和核苷(酸)类似物统治了20多年,他们或仍将统治很长的一个时期。虽然现阶段针对慢乙肝治疗的在研药物非常多,不少药物也进入临床试验,然而截止目前尚未发现有任何一款在研药物在临床试验中表现出彻底治愈慢乙肝潜能,是否跟临床试验受试对象数量较少、当前研究中监测的生物标志物以及药物本身的效用等有关尚有待明确。
由于慢乙肝的难治愈性问题,近些年,国内外均对慢乙肝的治愈概念进行不少探讨以期逐步实现彻底治愈目标。国内2015版慢乙肝指南提出了“慢乙肝临床治愈”概念,即停止治疗后血清HBV DNA 持续低于检测下限且HBsAg阴转或伴随抗HBs阳转、ALT正常、肝组织学病变轻微或无病变。在2017年的乙肝治疗终点工作组(Hepatitis B Treatment Endpoints Workshop,该工作组由AASLD和EASL联合成立)会议上也提出了三个慢乙肝治愈定义标准,但还没完全达成共识,分别是:1)完全治愈(complete sterilizing cure):血清中无法检测到HBsAg,根除HBV DNA,包括肝内 cccDNA 和整合 HBV DNA;2)功能性治愈(functional cure):在完成有限治疗后,血清中 HBsAg 和 HBV DNA 水平持续处于检测下限水平,伴随或不伴随乙型肝炎表面抗体(抗HBs)的血清学转换,肝功能恢复正常,肝细胞肝癌风险降低(还讨论了几个功能性治愈的指标,包括cccDNA转录完全停止,消除cccDNA,完全解决肝损伤,消除HCC风险);3)部分性治愈(partial cure):在完成有限治疗后,HBsAg处于可检测水平,但 HBV DNA 持续处于检测下限水平。
显然,在慢乙肝彻底治愈尚无法在短期内立即实现的情况下唯有采取分步实现策略。针对当前慢乙肝一旦用药后便需终身用药的无奈,现已逐渐达成共识——经过一定时间治疗后可安全停药且不发生病毒反弹(临床治愈/功能性治愈)!不难看出,新治愈概念对HBsAg阴转甚至出现抗HBs阳转提出了要求,这是现有核苷(酸)类似物无法达到的靶标。在研药物在临床试验监测过程中多将HBsAg作为监测效用的生物标志物之一,代表药物有RNAi疗法药物ARO-HBV、ARB-1467,衣壳抑制剂GLS4,核酸聚合物(NAPs)REP 2139 、 REP 2165,治疗性乙肝疫苗Nasvac、免疫调节剂Inarigivir (SB9200)等。实际临床试验中也观察到不少药物的确对HBsAg 的降低效果显著,部分药物单药或跟现有批准药物联合用药甚至可将部分患者的HBsAg降至低于检测下限水平甚至出现抗HBs阳转,一些患者在停药的随访期间也没有出现病毒的反弹,但最终结果仍有待更长期观察。随着技术进步,不断诞生作用更强新药,在可预见的不久,经过固定疗程治疗后安全停药且不发生病毒反弹这一目标可期。
不少在研药物在实验模型测试中降低HBV标志物如HBV DNA、HBV RNA、HBsAg和HBeAg等的表现令人满意,可一旦进入实际临床测试却往往无法达到临床前观测到的效果。跟现有HBV感染动物模型有关,目前绝大多数HBV感染动物模型尚无法完全模拟HBV感染人体复杂多变的环境,一些如土拨鼠模型、鸭模型、小鼠模型、树鼩模型、猴模型和猪模型等只能部分模拟人体环境,如HBV的高水平复制、HBV感染后的免疫、无法持续性出现病毒复制和表达HBV基因等这类问题目前尚未能在一种动物模型中进行全面的模拟,而一些大致可以模拟人体感染HBV环境的动物模型又多因伦理和成本高昂等问题难被大规模进行药物测试,因此,更好的HBV 感染动物模型的研究仍有待突破,目前的人工智能应用于生物医药的研发测试能否助一臂之力有待观察。只有能够比较容易的实现在动物模型中模拟人体感染HBV 的状态才更有可能测试出在人体临床用药中可等效于动物模型中观测到的药物效用。
现有标志物如HBV DNA、HBeAg或还无法完全满足临床需求,以至于某些慢乙肝患者停药后发生病毒反弹的情况经常发生,发现和开发满足临床需求的新生标志物也是当前的一大问题。如今的新药研发过程中已将一些新兴HBV生物标志物如HBV RNA、cccDNA、HBV pgRNA、抗-HBc、HBcrAg等纳入到新药试验过程的监测,某些药物也表现出对某个或某几个标志物具有一定的作用,而将这些新生标志物完全应用于实际临床的时机还未完全成熟,存在的问题如这些新生标志物对实验室环境要求过高,许多医院实验室/检验科环境完全没办法开展;缺乏便捷可用的生物标志物检测试剂;这些新生标志物对临床的指导临床意义还无法完全证实等等,这些都是将这些生物标志物应用于实际临床或药物研究面临的问题,这都有待更多、更大规模的临床研究加以解决。
展望
综上,随着对乙肝病毒在人体作用机制的进一步了解,针对乙肝病毒整个生命周期中各个靶点的药物也逐渐地被开发出来,这也是我们能看到全球竟有如此多针对乙肝的在研新药原因。从目前能接触到的公开在研新药数据看来,或许对慢乙肝的基础理论研究依然有待更进一步。目前理论研究认为,药物若能彻底清除肝细胞细胞核中的cccDNA应该可以真正实现慢乙肝的彻底治愈,从当前已公布的在研药物研究信息似乎还未能发现有任何一款药物能够达到这一目标。然这一概念是否真的可行有待实际临床研究加以证实,而若想对该概念进行彻底的印证,基础理论研究、动物模型研究、药物研发测试、检测新型生物标志物的实验室环境、检测标志物的生物试剂等这些条件都有待突破。




















评论