《自然》子刊:肿瘤完“蛋”!科学家发现肿瘤干细胞的生长极度依赖蛋氨酸,靶向这个通路,或能从根本上抑制肿瘤生长转移丨科学大发现

古语有云:“擒贼先擒王”。只要干掉了敌人的首领,敌人就极有可能崩溃,就如夜王死后的异鬼大军一样。
肿瘤中也存在这样的首领,被称之为“肿瘤干细胞”。肿瘤干细胞就像肿瘤细胞的母体一样,能不停地自我更新和分化,且极具侵袭性,对肿瘤的长期维持和转移至关重要;此外,肿瘤干细胞对化疗和放疗有极强的抗性,是很多肿瘤转移复发的罪魁祸首[1]。因此,针对肿瘤干细胞的治疗是彻底战胜肿瘤的基础。
近日,新加坡科学家终于在对抗肿瘤干细胞的道路上迈出了重要一步。他们发现,人类非小细胞肺癌的肿瘤干细胞对蛋氨酸(也叫甲硫氨酸)有近乎执着的偏爱。肿瘤干细胞需要大量的蛋氨酸,以维持自身组蛋白的甲基化,这对于肿瘤干细胞的生长和致瘤作用至关重要。
研究人员还发现,抑制蛋氨酸循环上的关键酶,可以大幅抑制肿瘤干细胞的生长和肿瘤的形成,且效果远好于现在治疗非小细胞肺癌的前线药物——顺铂。此外,他们还发现人类非小细胞肺癌组织中,这个酶有过量表达,是一个极具潜力的临床治疗靶点。相关论文发表在著名医学期刊《自然•医学》上,本文的通讯作者是Bing Lim 和Wai Leong Tam,第一作者是Zhenxun Wang和 Lian Yee Yip[2]。

Wai Leong Tam(最右,图片来自csi.nus.edu.sg)
身处生命科学的世纪~我们对癌症治疗已经取得了长足的进步。如今,各种新型抗癌药物的出现,延长了很多患者的生命。
然而,这些抗癌药物的治疗效果其实也有限,常常出现耐药性问题,很多癌症患者都会因复发和转移而失去生命。破解抗癌药物的耐药性,是当今癌症治疗领域的最大挑战之一。而癌症之所以产生耐药,并且容易复发,很大程度上是因为癌症干细胞的存在。
早在1937年时,有科学家就在白血病小鼠中发现,将单个的肿瘤细胞移植到其他小鼠中后,便可能形成新的肿瘤(致瘤性)。不过,这种能形成新肿瘤的肿瘤细胞数量特别少[3]。
而到了1960年代,著名肿瘤学家Pierce发现,在恶性肿瘤中存在少量高度致瘤性的肿瘤细胞,这些肿瘤细胞能分化成多种非致瘤性(移植后不能形成肿瘤)的肿瘤细胞。随后,Pierce和其他科学家一道,揭示了肿瘤细胞的分化层级,和干细胞的分化非常相似,这让Pierce提出了肿瘤干细胞的概念[3]。
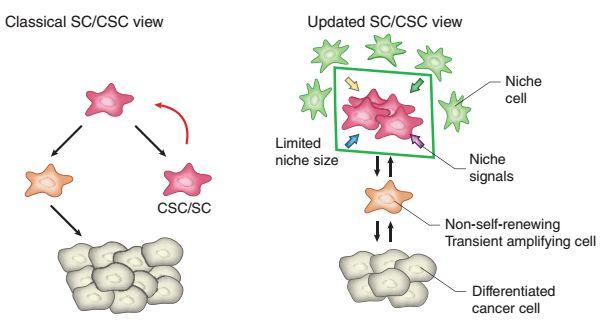
肿瘤干细胞模型
在之后的研究中,科学家又在多种癌症中发现了肿瘤干细胞存在的证据。并且发现它们具有很多独特的能力,比如具有很强的药物外排和DNA修复能力,能有效清除活性氧(ROS),使之免受伤害。这些都使肿瘤干细胞对化疗和放疗有极强的抗性。此外,肿瘤干细胞可以长期休眠,且粘附性较弱,是很多癌症能够复发和转移的根源[4]。
不仅如此,最近发表在顶级期刊《细胞》的一项研究还指出,肿瘤的免疫逃逸机制也可能是肿瘤干细胞进化出来的。这项研究发现,肿瘤干细胞在对抗免疫系统的过程中,会表达CD80这样一个原本是免疫细胞特有的受体,进而激活免疫抑制因子CTLA4的表达,抑制免疫系统[5]。 2018年,科学家在对患者进行Car-T治疗的过程中发现,仅仅一个癌细胞便引起肿瘤的复发,导致患者死亡[6]。
肿瘤干细胞的存在加大了治疗癌症的难度。如果我们不能对付肿瘤干细胞,那治愈癌症将无从谈起。
很多科学家都在努力寻找肿瘤干细胞的弱点。现在很多研究都发现,肿瘤细胞在代谢途径迥异于正常细胞,如爱舔油等等。既然,肿瘤干细胞有过人的本领,那它必然也有独特的代谢途径,以支撑其强大的能力。
新加坡的Bing Lim 和Wai Leong两位科学家的团队,便致力于肿瘤代谢途径的研究。

Bing Lim 博士(图片来自a-star.edu.sg)
他们从非小细胞肺癌患者的原发组织中,分离出富含肿瘤干细胞的原代细胞细,并扩大培养。随后,利用液相色谱-质谱技术进行分析,发现肿瘤干细胞中蛋氨酸循环相关的代谢物高度富集。于是,研究人员对肿瘤干细胞中的蛋氨酸进行了重点研究。
蛋氨酸是细胞必需的氨基酸,需从外界补充。蛋氨酸在细胞中发挥着重要作用,除了作为蛋白质翻译时的起始氨基酸外,其参与的蛋氨酸循环也为细胞提供大量的代谢产物,这些代谢产物的一个重要作用是负责染色体组蛋白的甲基化,调节各种基因的表达。之前有研究发现,组蛋白甲基化的上调与多种癌症有关[7]。
研究人员短暂剥夺营养液中的蛋氨酸,发现肿瘤干细胞很快便失去了肿瘤形成能力,无法致瘤,同时也观察到组蛋白甲基化明显下降。而其他氨基酸,如苏氨酸、亮氨酸或色氨酸等,则没有这种影响。这说明,蛋氨酸在肿瘤干细胞的致瘤能力中发挥着关键作用。

蛋氨酸对肿瘤干细胞的致瘤能力非常重要
随后,研究人员又对蛋氨酸循环中的两个关键酶:MAT2A(蛋氨酸腺苷转移酶IIα)和SAHH(S-腺苷同型半胱氨酸水解酶)进行抑制,也发现能够逆转肿瘤干细胞组蛋白的甲基化,抑制其肿瘤形成能力。
尤其MAT2A的抑制剂FIDAS-5(已在结肠癌中被证明具有抗癌能力[8]),会完全消除肿瘤干细胞组蛋白的甲基化,并能接近完全消灭其形成肿瘤的能力。而FIDAS-5对普通的肿瘤细胞以及正常细胞NIH 3T3则没有什么影响,显示了其作用的高度特异性。
此外,研究人员还发现,人类非小细胞肺癌组织中,MAT2A蛋白有异常高表达。而将非小细胞肺癌的肿瘤干细胞移植到小鼠身上,然后分别用安慰剂(玉米油)、顺铂、FIDAS-5进行治疗,发现FIDAS-5几乎能完全抑制肿瘤的生长,而顺铂却没什么效果。这表明,针对MAT2A的抑制剂,有强大的临床应用价值。
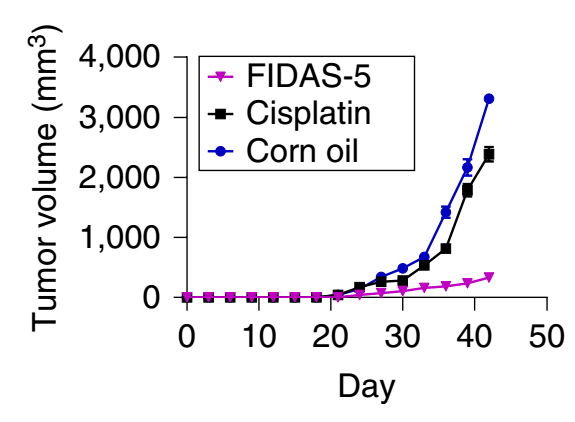
FIDAS-5抗癌效果明显
这些实验表明,MAT2A蛋白可以作为非小细胞肺癌的潜在靶点,并克服常用化疗药物顺铂的耐药性。
当然,研究还有一些不足之处,那就是研究人员并没有阐明染色体上具体哪些位点的组蛋白甲基化在起作用,这是他们接下来会做的事情。而对这些机制的研究,也将为人们对付肿瘤指明新的道路。
编辑神叨叨
肿瘤干细胞有点像生化模式里的母体幽灵~
如果想及时获取第一手科研资讯,那你绝对不能错过瞬息~而瞬息又推出了全新版块——瞬间。瞬间可以给大家提供更多:
比如全球新药研发的动态;
比如最新学术研究的热辣点评;
比如一线临床医生的所做所思;
还比如,比如你医学工作中的某一个瞬间。。。
只要有那么一瞬间,有一百万种可能。点击瞬间图片,分享你此刻的医学时光吧,朋友们!
对,就这个图,点就行!
参考文献:
[1] Obrien C A, Kreso A, Dick J E, et al. Cancer Stem Cells in Solid Tumors: An Overview[J]. Seminars in Radiation Oncology, 2009, 19(2): 71-77.
[2] Zhenxun Wang et al.Methionine is a metabolic dependency of tumor-initiating cells. Nature Medicine, 2019, Doi.org/10.1038/s41591-019-0423-5.
[3] Clevers H. The cancer stem cell: premises, promises and challenges[J]. Nature Medicine, 2011, 17(3): 313-319
[4] Batlle E, Clevers H. Cancer stem cells revisited[J]. Nature Medicine, 2017, 23(10): 1124-1134.
[5] Yuxuan Miao et al. Adaptive Immune Resistance Emerges from Tumor-Initiating Stem Cells. Cell ,2019, 177, 1–15. Doi.org/10.1016/j.cell.2019.03.025
[6] Ruella M, Xu J, Barrett D M, et al. Induction of resistance to chimeric antigen receptor T cell therapy by transduction of a single leukemic B cell.[J]. Nature Medicine, 2018, 24(10).
[6] 王珊. 精氨酸甲基化转移酶1对神经胶质瘤细胞生长的影响及作用机制研究[D]. 北京协和医学院, 2012.
[8] Zhang W, Sviripa V M, Chen X, et al. Fluorinated N,N-dialkylaminostilbenes repress colon cancer by targeting methionine S-adenosyltransferase 2A.[J]. ACS Chemical Biology, 2013, 8(4): 796-803.


本文作者 | 低温艺术家


















评论