与生俱来的心血管病风险——脂蛋白a 「Lp(a)」|安贞心语
冠心病是一个多因素导致的疾病,传统的危险因素包括吸烟、高血压、糖尿病、高血脂、肥胖等可控性因素。但是临床上有很多不具备上述易患因素的患者却患有了早发性冠心病。除了众所周知的家族史外,是否还有其他遗传因素可以预测冠心病的风险呢。本期的「安贞心语」栏目,我们关注一个大家都听说过又不十分了解的血脂相关指标——脂蛋白a [Lp(a)]。虽然大家都知道Lp(a)和冠心病有一定关系,但Lp(a)在冠心病的发展进程中到底扮演什么样的角色?到目前为止,仍旧是个谜。我们结合发表在JACC上的一篇文章,来看看相对于冠心病家族史及早发冠心病家族史,Lp(a)能否独立地预测冠心病的发生?让我们一起慢慢的揭开Lp(a)神秘的面纱吧。
作者:蔡高军 江苏大学附属武进医院
审阅:刘巍 首都医科大学附属北京安贞医院
点评:贺阳 贺永明 苏州大学附属第一院
Lp(a)是什么?
早在1963年,挪威遗传学家Berg K从血浆中分离出一种蛋白脂质复合体颗粒,称之为Lp(a)。其相对分子量为4600~5600kD,结构与低密度脂蛋白(LDL)类似,内核富含胆固醇酯,外壳表层除有游离胆固醇、磷脂和载脂蛋白B100,还有一个以二硫键与载脂蛋白B100连接的apo(a)(图1)。
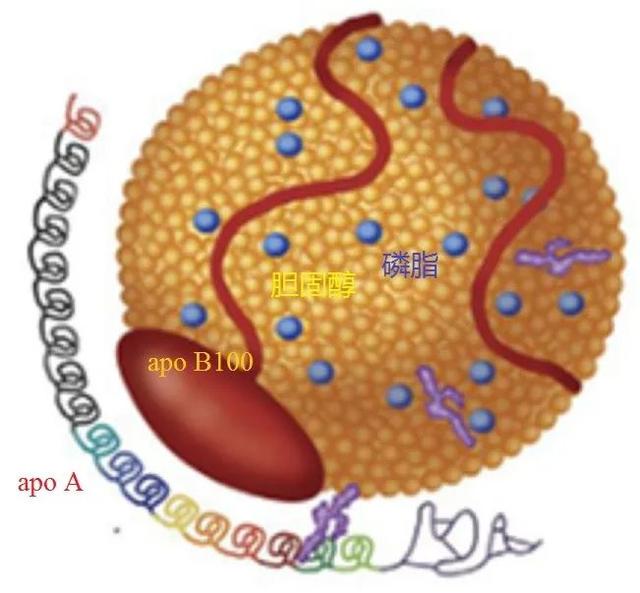
图1 Lp(a)的结构
人群中Lp(a)血浆浓度主要受遗传因素的影响,几乎不受年龄、体重、饮食、运动和传统降脂药物的影响。个体间Lp(a)差异大,总体呈低浓度偏态分布。
Lp(a)与动脉粥样硬化性心血管疾病(ASCVD)之间相爱相杀了半个多世纪。有研究表明,Lp(a)可通过促进泡沫细胞形成、斑块中脂质的沉积以及血栓形成和炎症反应参与动脉粥样硬化的各个阶段;Lp(a)中的apo(a)与纤维蛋白溶酶原具有高度的结构同源及生物化学性质,也能影响纤溶系统。但是,Lp(a)在ASCVD发展进程中到底扮演什么样的角色?到目前为止,仍旧是个谜。

研究背景
研究表明,Lp(a)和冠心病(CHD)家族史作为非传统的心血管危险标志物,可能是ASCVD的两个独立危险因素。但是,其独立及联合的长期ASCVD风险仍不清楚。
近期,Mehta A教授在J Am Coll Cardiol上发表了其基于两个社区无症状人群(ARIC,社区动脉粥样硬化风险研究;DHS,达拉斯心脏研究)的长期队列研究结果,分析了Lp(a)及冠心病家族史与社区无症状人群中发生ASCVD和CHD事件的关系。

研究方法
入选对象:来自ARIC(12,149名)和DHS(2,756名)的研究中无心血管疾病,且基线及随访数据完整人群。
Lp(a)水平测量方法:ARIC研究队列中,采用对apoA结构中Kringle IV重复序列敏感分析方法测量第1次访视时Lp(a)水平,采用对Kringle IV重复序列不敏感的自动免疫比浊法,在第4次访视时再次测定Lp(a)水平。采用夹心酶联免疫吸附方法(也对apo(a)大小不敏感)检测DHS队列中人群Lp(a)水平。
冠心病家族史(FHx)的定义:ARIC研究中采用自我报告方式;早发家族史定义为心肌梗死发生时,父亲<55岁,母亲<60岁。而DHS研究采用问卷方式,任何一级亲属有心肌梗死史定义为有家族史;早发家族史的定义为男性<50岁,女性<55岁。
心血管结局:将随访至初次发生ASCVD或者CHD的时间作为终点。ARIC队列和DHS队列平均随访时间分别为21.1和11.9年。ASCVD事件定义为首次冠状动脉性死亡、非致死性心肌梗死、致死或非致死性卒中。CHD事件定义为冠状动脉性死亡或非致死性心肌梗死。
统计学方法:Lp(a)按照不同种族最高五分位人群作为高Lp(a)组;采用Cox风险回归模型评估Lp(a)与发生ASCVD或CHD事件的时间的相关性;加入家族史和早发家族史做为协变量检测其与Lp(a)的交互作用。研究还根据Lp(a)水平和是否有家族史分成4组,分析Lp(a)与家族史对ASCVD和CHD风险的联合效应。采用净重分类改善指标、综合判别改善指数、C统计量等评估心血管风险再分类及判断改善情况。
研究结果
1. 按有无家族史分组的基线特征
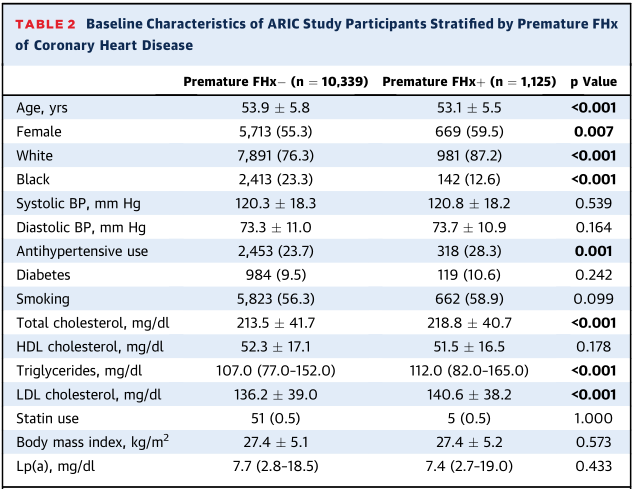
ARIC研究中(表1),平均年龄53.9±5.7岁,56.1%为女性,76.8%白人,22.9%黑人,44.4%有家族史,9.8%有早发家族史。与无家族史比较,有家族史者年龄更大,女性和白人比例更高,服用高血压药物的比例更高,血脂水平更差;与无早发家族史比较,早发家族史者除了年龄略低外,其它与家族史亚组中的表现相似。DHS研究中平均年龄43.6±9.9岁,56.8%为女性,32.1%白人,49.6%黑人,31.1%有家族史,10.1%有早发家族史。
表1 ARIC研究中按是否有冠心病家族史分组的基线特征
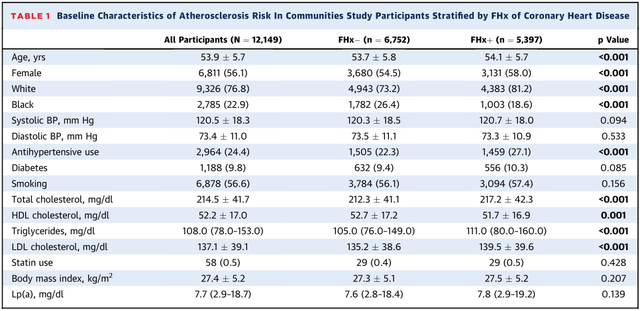
表2 ARIC研究中按是否有早发冠心病家族史分组的基线特征
2. 人群中Lp(a)的分布特点
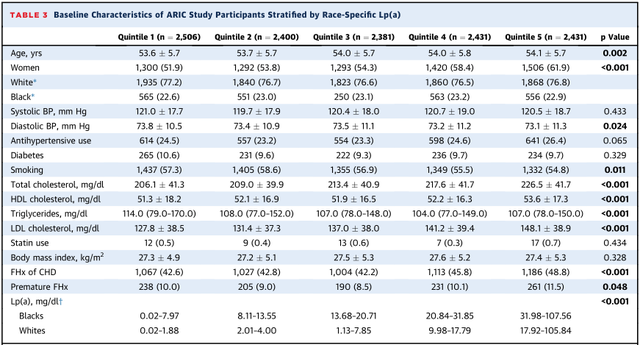
按照种族特异性Lp(a)五分位间距分组,组间比较女性比例有升高趋势,而吸烟比例有下降趋势。年龄、总胆固醇、低密度脂蛋白胆固醇随Lp(a)升高而升高,而舒张压和甘油三酯水平则随Lp(a)升高而降低。白人最高五分位Lp(a)>17.92 mg/dl,而黑人>31.98mg/dl。另外,家族史和早发家族史比例也随Lp(a)的升高而增加。
表3 ARIC研究中按种族Lp(a)五分位间距分组之间的基线特征
3. Lp(a)及冠心病家族史与心血管事件有独立相关性
ARIC研究随访中共有3114人发生ASCVD,2283例发生CHD。冠心病家族史增加17%(HR:1.17; 95%CI:1.09-1.26, P<0.01),高Lp(a)增加了25%(HR:1.25; 95%CI:1.12-1.40, P<0.001)ASCVD风险;冠心病家族史增加31%(HR:1.31; 95%CI:1.20-1.42, P<0.001),高Lp(a)增加了27%(HR:1.27; 95%CI:1.12-1.45, P<0.001)的CHD风险。早发家族史增加25%(HR:1.25; 95%CI:1.11-1.41, P<0.01)的ASCVD风险和43%(HR:1.43; 95%CI:1.26-1.63, P<0.01)的CHD的发病风险。
DHS研究随访发生161例ASCVD和73例CHD事件。家族史增加65%(HR:1.65; 95%CI:1.19-2.28, P=0.002)ASCVD风险和118%(HR:2.18; 95%CI:1.35-3.52, P=0.001)CHD风险。高Lp(a)增加237%(HR:3.37; 95%CI:1.41-8.06, P=0.006)CHD风险。同时,早发家族史增加112%(HR:2.12; 95%CI:1.19-3.78, P=0.011)CHD风险。
4. Lp(a)及冠心病家族史和心血管事件的联合效应
ARIC研究中,按照Lp(a)水平和是否有冠心病家族史分成4组:高Lp(a)+有家族史组;高Lp(a)+无家族史组;非高Lp(a)+有家族史组,非高Lp(a)+无家族史组。随访发现,高Lp(a)+有家族史组累积ASCVD和CHD发生率最高(图2)。与非高Lp(a)+无家族史组比较,高Lp(a)+有家族史组分别增加43%(HR: 1.43; 95%CI:1.27-1.62)ASCVD风险和68%(HR: 1.68; 95%CI:1.47-1.93)CHD风险(图3)。与非高Lp(a)+无早发冠心病组比较,高Lp(a)+有早发冠心病组ASCVD和CHD风险分别增加74%和114%(图4、5)。
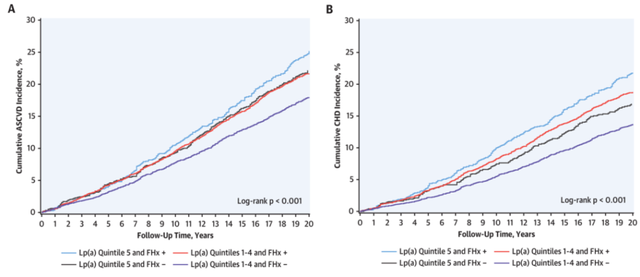
图2 ARIC研究按照Lp(a)水平和家族史分组间累积ASCVD和CHD发生率

图3 ARIC研究按照Lp(a)水平和家族史分组间ASCVD和CHD发病风险
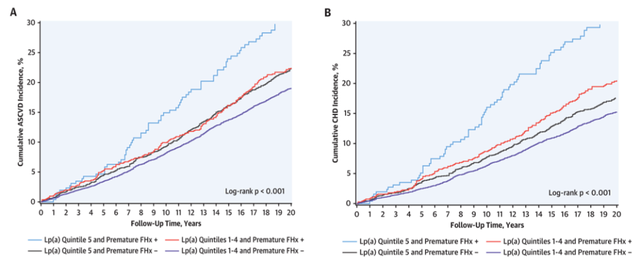
图4 ARIC研究按照Lp(a)水平和早发家族史分组间累积ASCVD和CHD发生率
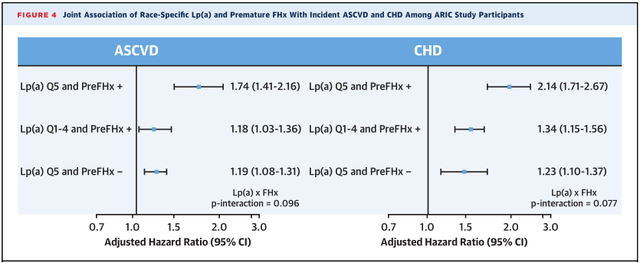
图5 ARIC研究按照Lp(a)水平和早发家族史分组间ASCVD和CHD发病风险
与ARIC研究不同,在DSH队列研究中,高Lp(a)与家族史、高Lp(a)与早发家族史间存在交互作用。与其他组比较,高Lp(a)+有家族史和高Lp(a)+有早发家族史组增加2-3倍ASCVD风险,5-8倍的CHD风险。
5. Lp(a)和家族史对心血管风险再分类和判断的影响
在ARIC人群中,在ASCVD和CHD的传统危险因素模型中,加入高Lp(a)和家族史,能增加ASCVD和CHD事件净再分类改善指数和综合判断指数。
6. 敏感性分析
以Lp(a)≥50mg/dl分组,用Lp(a)中胆固醇校正总胆固醇水平,以第4次访视时的Lp(a)值作为起点重新分析,进行敏感性分析。三种方法的结果没有明显变化,说明该研究结果比较稳健、可靠。
研究结论
本研究发现:
1.和家族史、以及早发家族史一样,Lp(a)的升高,可以独立的预测与社区无症状人群的长期ASCVD及CHD风险;其中DHS研究中Lp(a)升高更是使得CHD的风险增加3.37倍,而早发冠心病的家族史也只是使CHD的风险增加2.12倍。
2.将高Lp(a)和家族史联合,预测ASCVD及CHD风险效力更高;两个因素均为阳性,比一个阳性的风险预测提高1倍。
3.在传统风险因素中加入Lp(a)及家族史,可以进一步的提高对CHD及ASCVD发生的综合判断指数。
看来高Lp(a)和家族史这两个非传统心血管危险因素能帮助识别无症状人群心血管风险,有助于指导制定一级心血管疾病的预防策略。
参考文献:
1. Tsimikas S. A test in context: lipoprotein(a): diagnosis, prognosis, controversies, and emerging therapies. J Am Coll Cardiol 2017; 69: 692–711.
2. Clarke R, Peden JF, Hopewell JC, et al. Genetic variants associated with Lp(a) lipoprotein level and coronary disease. N Engl J Med 2009; 361: 2518–28.
3. Emerging Risk Factors Collaboration, Erqou S, Kaptoge S, et al. Lipoprotein(a) concentration and the risk of coronary heart disease, stroke, and nonvascular mortality. JAMA 2009; 302: 412–23.
4. Virani SS, Brautbar A, Davis BC, et al. Associations between lipoprotein(a) levels and cardiovascular outcomes in black and white subjects: the Atherosclerosis Risk in Communities (ARIC) study. Circulation 2012; 125: 241–9.
5. Kamstrup PR, Tybjaerg-Hansen A, Nordestgaard BG. Extreme lipoprotein(a) levels and improved cardiovascular risk prediction. J Am Coll Cardiol 2013; 61: 1146–56.
6. Waldeyer C, Makarova N, Zeller T, et al. Lipoprotein(a) and the risk of cardiovascular disease in the European population: results from the Bio-marCaRE consortium. Eur Heart J 2017; 38: 2490–8.
7. Lloyd-Jones DM, Nam BH, D’Agostino RB, Sr., et al. Parental cardiovascular disease as a risk factor for cardiovascular disease in middle-aged adults: a prospective study of parents and offspring. JAMA 2004; 291: 2204–11.
危险因素之间[以Lp(a)为例]的协同作用:一个被长期忽略的问题
苏州大学附属第一医院急危重症医学 贺阳
苏州大学附属第一医院心内科 贺永明
危险因素A可独立致病D(假如风险HRA=1.2),危险因素B(假如风险HRB=1.1)也可独立致病D,随之而来的问题是,危险因素A和B同时存在时对D如何影响?也就是说A和B是否对疾病存在协同作用,即HRA+HRB>1.2+1.1,还是简单地相加作用,即HRA+HRB=1.2+1.1。两个危险因素之间的交互(协同)作用的数学模型包括相加模型及相乘模型,一般认为,通过加法模型来分析生物学交互作用更为科学,衡量交互作用大小的关键指标为相对剩余风险(relative excess risk due to interaction,RERI)[1]。
1963年,挪威生理学家Berg首先发现了脂蛋白(a),Lp(a)在相当长时间内如“迷一般的存在”,我们对其结构和功能知之甚少[2]。1987年,McLean成功克隆出载脂蛋白(a)(apolipoprotein(a),apo(a))这一Lp(a)关键结构[3]。Lp(a)包括1个富含胆固醇的低密度脂蛋白(Low density lipoprotein, LDL)核心,1分子载脂蛋白B100(apolipoprotein B100, apo B100)及1分子apo(a),两者由一条二硫键连接共同附着于LDL表面[4]。人群Lp(a)浓度个体差异极大,波动于0.1~2000mg/dL之间,这一浓度差异>90%可由遗传获得解释。编码人apo(a)的LPA基因包涵3个阈:1个KIV、1个KV和1个蛋白阈,其中KIV发生变异,可形成10种不同KIV(KIV 1-0)。10种KIV中,在1个等位基因上仅KIV-2就存在2~>40多拷贝形式,因此,鲜有2个等位基因具有相同KIV-2拷贝数的个体。KIV-2拷贝变异(KIV-2 copy number variation, KIV-2 CNV)导致人群apo(a)多态性,而>95%人群的LPA基因为杂合子。这些原因解释了Lp(a)检测困难及个体间的浓度差异[3, 5]。流行病学、遗传学及全基因组关联研究表明,Lp(a)系动脉粥样硬化及主动脉瓣钙化的危险因素[4, 6-11]。冠心病家属史是动脉粥样硬化疾病的另一个危险因素[12]。
Mehta等研究了2个队列,即ARIC(Atherosclerosis Risk In Communities,N=12149)和DHS(Dallas Heart Study,N=2756)队列,结果发现Lp(a)和冠心病家族史对ASCVD和CHD存在交互作用,单纯冠心病家族史使ASCVD增加16%,单纯Lp(a)增高使ASCVD增加20%,两个危险因素共同存在时,ASCVD增加43%(>16%+20%);同样,单纯冠心病家族史使CHD增加30%,单纯Lp(a)增高使CHD增加27%,两个危险因素同时存在时,CHD增加68%,大于两个危险因素的简单相加。当这2个危险因素分别参与构造CHD预测模型时,再分类改善指数(net reclassification index,NRI)、综合分辨指数(integrated discrimination index,IDI)及Harrell-C指数均有显著改善,2个危险因素同时参与构造预测模型时,改善更明显[13];当上述两个危险因素构造ASCVD预测模型时,所获结果类似,但Harrell-C指数未见显著增加。这一研究的临床意义明显,但显而易见的不足在于,未能量化出Lp(a)和冠心病家族史2个危险因素交互作用对于ASCVD及CHD的影响,即未给出RERI,并至少在统计学上证明其显著意义[13]。同时引入Lp(a)和冠心病家族史可以改善模型的预测能力,但并不等于说这2个危险因素存在交互作用,并因此改善了模型的预测能力,这是两个完全不同的概念。
我们近来的研究也注意到了Lp(a)与低密度胆固醇(LDL-C)[14]及身高体重指数(BMI)[15]之间的交互作用(N=3213)。结果发现,单纯LDL-C升高(参考值<2.6mmol/L)使急性心肌梗死增加1.66倍(OR=2.66, 95%CI, 1.78-3.98),单纯Lp(a)升高(第5分位vs第1分位)使急性心梗死也增加1.66倍(OR=2.66, 95%CI, 1.88-3.76),两者均升高(LDL-C>2.6mmol/L且Lp(a)位于第5分位)时,急性心肌梗死增加6.48倍(OR=7.48, 95%CI, 4.90-11.44),多因素校正的RERI为3.01,95%CI 0.58-5.44(P=0.015)。
Mehta等给我们提供了一个研究危险因素间协同作用的范例,提醒我们既要研究单一危险因素,又要研究危险因素间的交互作用,以便深刻理解这些危险因素对疾病的影响,因为这个世界是如此地紧密联系。
参考文献:
[1] Knol MJ, Vanderweele TJ. Recommendations for presenting analyses of effect modification and interaction. International Journal of Epidemiology 2012; 41: 514-520.
[2] Berg K. A New Serum Type System in Man--the Lp System. Acta Pathol Microbiol Scand 1963; 59: 369-382.
[3] McLean JW, Tomlinson JE, Kuang WJ, et al. cDNA sequence of human apolipoprotein(a) is homologous to plasminogen. Nature 1987; 330: 132-137.
[4] Nordestgaard BG, Chapman MJ, Ray K, et al. Lipoprotein(a) as a cardiovascular risk factor: current status. Eur Heart J 2010; 31: 2844-2853.
[5] Utermann G. The mysteries of lipoprotein(a). Science 1989; 246: 904-910.
[6] Kamstrup PR, Tybjaerg-Hansen A, Nordestgaard BG. Elevated lipoprotein(a) and risk of aortic valve stenosis in the general population. J Am Coll Cardiol 2014; 63: 470-477.
[7] Thanassoulis G, Campbell CY, Owens DS, et al. Genetic associations with valvular calcification and aortic stenosis. N Engl J Med 2013; 368: 503-512.
[8] Kamstrup PR, Benn M, Tybjaerg-Hansen A, Nordestgaard BG. Extreme lipoprotein(a) levels and risk of myocardial infarction in the general population: the Copenhagen City Heart Study. Circulation 2008; 117: 176-184.
[9] O'Donoghue ML, Morrow DA, Tsimikas S, et al. Lipoprotein(a) for risk assessment in patients with established coronary artery disease. J Am Coll Cardiol 2014; 63: 520-527.
[10] Zhang Y, Jin JL, Cao YX, et al. Lipoprotein (a) predicts recurrent worse outcomes in type 2 diabetes mellitus patients with prior cardiovascular events: a prospective, observational cohort study. Cardiovasc Diabetol 2020; 19: 111.
[11] Cai DP, He YM, Yang XJ, Zhao X, Xu HF. Lipoprotein (a) is a risk factor for coronary artery disease in Chinese Han ethnic population modified by some traditional risk factors: A cross-sectional study of 3462 cases and 6125 controls. Clin Chim Acta 2015; 451: 278-286.
[12] Lloyd-Jones DM, Nam BH, D'Agostino RB, Sr., et al. Parental cardiovascular disease as a risk factor for cardiovascular disease in middle-aged adults: a prospective study of parents and offspring. JAMA 2004; 291: 2204-2211.
[13] Mehta A, Virani SS, Ayers CR, et al. Lipoprotein(a) and Family History Predict Cardiovascular Disease Risk. J Am Coll Cardiol 2020; 76: 781-793.
[14] Hu Y, Tao JY, Cai DP, He YM. Interaction of lipoprotein(a) with low-density lipoprotein cholesterol on first incident acute myocardial infarction. Clin Chim Acta 2019; 501: 1-5.
[15] Teng RL, Wang H, Sun BC, Cai DP, He YM. Interaction between lipoprotein (a) levels and body mass index in first incident acute myocardial infarction. BMC Cardiovasc Disord 2020; 20: 350.
专家简介

蔡高军
江苏大学附属武进医院
蔡高军,男,江苏大学附属武进医院心内科副主任,副主任医师,副教授,硕士生导师,首都医科大学附属安贞医院在读博士。加拿大多伦多大学访问学者;2016年江苏省“科教强卫”青年医学人才,常州市青年科技人才。
发表医学论文40余篇,其中 SCI论文20篇。担任“LIPIDS HEALTH DIS”及“BMC Cardiovascular Disorders”杂志副编辑,“现代药物与临床杂志”青年编委,中华医学会“中华卫生应急电子杂志”学术委员会委员,国内外多个学术期刊审稿专家。
专家简介

刘巍
首都医科大学附属北京安贞医院
首都医科大学附属北京安贞医院心内科主任医师,副教授,硕士生导师,博士,先后在新加坡国立大学Tan Tock Seng医院,日本东邦大学大森医院心血管介入中心,美国休斯顿德州医学中心Methodist医院Debacky心血管中心及德州大学医学部接受心内科及心血管介入培训。
擅长冠心病诊治,结构性心脏介入治疗。
目前担任欧洲心脏病学会委员,美国心脏协会委员,中华医学会心血管分会冠心病与动脉粥样硬化学组委员,北京医学会心血管分会青委会副主任委员,中国医师协会心血管分会青年委员。
专家简介

贺永明
苏州大学附属第一院
贺永明,男,医学博士,苏州大学附属第一院心内科主任医师,教授,博士研究生导师。
中国心血管医生创新俱乐部(CCI)三期学员。江苏省第4期“333高层次人才”第三层次培养对象,苏州市“首批姑苏卫生重点人才”。2011年,受江苏省卫生厅公派赴加拿大渥太华大学心脏研究所研修冠心病介入治疗;2014年,赴香港中文大学威尔斯亲王医院李嘉诚医学研究所研修冠心病的炎症机制。
在《中华心血管病杂志》、《中华内分泌与代谢杂志》、Acta Diabetol, Clin Nucl Med, Int J Cardiol等发表医学论文50余篇,其中SCI收录20余篇,编著《核素心肌显像与临床冠心病》1部。Cardiology Plus特约审稿人,Annals of Translational Medicine及BMC Cardiovascular Disease杂志副编辑(Associate editor)。
多次在国际国内心血管大会上发言。主持国家自然科学基金面上项目1项,主持多项省市级社会发展项目。获江苏省科技进步三等奖1项;多次获市厅级奖项。






















评论