十载天演,下一个Genmab?| 江湖
• 天演在ASCO年会上发布首个CTLA-4安全抗体ADG126临床研究数据。
• 在AACR年会上,天演展示了多个安全抗体研究数据(包括CD47、CD137靶点)及首个双屏蔽双抗临床前安全数据(HER2×CD3),并计划向监管部门递交多款安全抗体临床研究申请。
• 天演正在开发曾被认为抗体研发禁区的CD28靶点,在靶位及安全性上有创新突破。
• 今年下半年,天演在临床方面将重点公布ADG116/ADG126分别与抗PD-1抗体联用的安全性及有效性数据,并持续更新单药于高剂量组扩展的临床数据。
天演药业成立至今11年,前期公司花费大量时间打造技术平台。目前其已拥有新表位抗体(NEObody™)、安全抗体(SAFEbody®)及强力抗体(POWERbody™)三大抗体平台,近两年随着技术开发逐渐成熟,天演开始频繁在国际会议上发布产品研究数据。
在今年的美国临床肿瘤学会年会(以下简称ASCO)及美国癌症研究学会年会(以下简称AACR)上,天演又发布了多个产品数据。包括ASCO上公布的掩蔽型抗CTLA-4安全抗体ADG126的I期临床研究数据,以及AACR上公布的经过 Fc 端优化的抗 CD137 IgG1 掩蔽抗体ADG206、抗CD47的IgG1掩蔽抗体ADG153、针对实体瘤的双掩蔽HER2xCD3双特异性T细胞接合器(TCE)抗体ADG138,以及肿瘤靶向的双特异性CD28强力抗体(POWERbody™)平台的临床前候选抗体数据。
首个抗CTLA-4安全抗体临床数据
今年ASCO上展示的ADG126临床数据,是天演首次对外发布安全抗体(SAFEbody®)产品的临床研究数据。ADG126单药在各剂量组重复给药中均表现出优异的安全性。
ADG126针对的CTLA-4靶点,也是外界对安全抗体技术应用有较高期待的一个靶点。天演亦希望能通过安全抗体技术充分挖掘并发挥CTLA-4强力清除肿瘤微环境中调节性T细胞并发挥柔性阻断效果,以期释放该靶标作为癌症治疗基石的巨大潜力。
CTLA-4靶点发现至今已有30年,但获批用于肿瘤治疗的抗体仅有BMS的伊匹单抗,2021年全球销售额20.26亿美元。剂量相关毒性限制了该靶点更多产品研发,也限制了已上市产品的应用范围及疗效。
鉴于此,为提高抗CTLA-4抗体有效性,并减少安全性问题,天演对抗CTLA-4抗体作了两方面创新:一是选择与伊匹单抗不一样的CTLA-4蛋白结合表位;二是利用安全抗体技术,在抗体的Fab端链接掩蔽肽,使其只在肿瘤微环境中激活。
ADG116为靶向CTLA-4独特保守表位产生的新表位抗体(NEObody™)。从天演此前发布的动物实验数据看,ADG116的ADCC效应较伊匹单抗提高10倍,安全性也有较大提高,临床研究中的最高爬坡剂量可达15mg/kg,同时ADG116对肿瘤微环境中调节性T细胞(Treg)有更强的清除作用。天演又在ADG116的基础上打造了安全抗体ADG126。
从本次ASCO公布的数据看,产品安全性进一步提高,新的临床数据展现了天演CTLA-4靶点产品成为同类最佳的潜力,有望解决抗CTLA-4疗法因剂量限制安全性问题而导致的未满足的临床需求。
ASCO公布的ADG126 Ⅰb/Ⅱ期临床试验第一阶段剂量递增研究中期数据,共统计16例病人的研究结果,这些病人都接受了ADG126单药每三周一次静脉注射给药,最大剂量为10 mg/kg。数据显示所有病人中,仅出现1级治疗相关不良事件(TRAE),最常见的为疲劳(19%)和瘙痒(13%),未观察到剂量限制性毒性及治疗相关严重不良事件(SAE)。
简单数据对比显示,ADG126较ADG116有更好的治疗耐受性。去年天演于ESMO-IO公布了ADG116的临床研究结果,其中在10 mg/kg剂量组,仍有一位先前接受5年纳武单抗(nivolumab)治疗后复发的肾细胞癌患者,出现皮疹(3级)和剂量限制性毒性(4级高血糖)。而截止今年ASCO数据发布日期,ADG126在已公开的既有数据中,不良反应都控制在了1级范围。
与伊匹单抗过往的研究数据对照,ADG126在安全性方面优势明显。如下图所示,伊匹单抗在3mg/kg给药剂量时,3级以上不良反应的发生率为20%~27%,当给药剂量上升到10mg/kg时,3级以上不良反应的发生率至少为36%,且有相当比例病人因不良反应终止治疗。

图1 伊匹单抗过往研究安全性数据汇总
天演也对ADG126的安全性表现出较大信心,还在进一步探索ADG116与ADG126单药在高剂量上的扩展以及与PD-1联用的安全性及有效性数据。据天演最新演讲公开的数据,ADG126已顺利完成20mg/kg的安全剂量评估,同时继续开展10mg/kg剂量的扩展研究。
本次ASCO也展示了ADG126的初步疗效数据。截止今年2月15日,16名患者中有5人病情稳定,同时观察到两例“冷肿瘤”病人对治疗产生反应,一例是卵巢肿瘤病人,经过ADG126剂量为1mg/kg的第七次治疗,在该剂量下重复给药致活化的 ADG126 稳步积累,表征其临床获益的重要肿瘤生物标志物CA-125值持续下降77%。另一例是经纳武单抗与伊匹单抗联合治疗后病情进展的葡萄膜黑色素瘤患者。天演提到,给药后两者目标病灶处的肿瘤均出现持续缩小且超20%,CD8+ T细胞数量增加。
这一数据再度显示,天演抗CTLA-4抗体在“冷肿瘤”中的潜在治疗效果。去年公布的临床结果,ADG116在胰腺癌和卵巢癌等“冷”肿瘤中也观察到初步疗效信号。一位胰腺癌患者经两轮10 mg/kg剂量ADG116给药后,目标病灶处的肿瘤缩减22%(数据截止日期2021年10月15日),非目标病灶(23毫米x 12毫米)完全消失,且病人只出现1级TRAE。此外,6mg/kg剂量组的一位卵巢癌患者经治疗长时间保持疾病稳定。
天演目前正在同时推进ADG116和ADG126的单药及与PD-1联用的临床开发。其在抗体开发方面有与众不同之处:针对同靶点开发多个候选药物,以满足不同用药场景的需求。
针对这一开发模式,天演的创始人罗培志做过一个比喻:这就像平板电脑和台式电脑,它们的功能大同小异,但各自都有更适合的应用场景。延伸到抗体设计上,未作掩蔽处理的ADG116起效更快,有可能让肿瘤迅速缩小,而经掩蔽处理的ADG126需要在被激活后发挥药效,但用药不良反应更小、半衰期长(ASCO数据也提到其总半衰期增加了1.7倍),有助于进一步提高用药病人的生活质量。
将此结合当下的肿瘤临床治疗理念,ADG116与ADG126值得进一步探索在新辅助治疗与术后辅助治疗场景中的价值。
首个双掩蔽双抗临床前数据
今年召开的AACR上,天演也公布了另外4款产品的临床前数据,分别为ADG206(CD137抗体)、ADG153(CD47抗体)、双特异性T细胞接合器ADG138(HER2×CD3)以及CD28强力抗体平台,也展现出较好的安全性和抗肿瘤活性。其中,ADG138是天演首度对外披露双掩蔽双抗临床前数据的产品。
天演表示,接下来将根据公司最新战略规划决定向相关监管部门递交安全抗体候选药物的临床研究申请。
ADG206
ADG206是天演在CD137靶点上设计的迭代产品。与此前已进入临床Ⅰb/Ⅱ期的同靶点产品ADG106相比,其在保留ADG106安全性及有效表位的基础上,增加了掩蔽肽以增强该激动剂的安全性,另外Fc端从IgG4换成IgG1并进一步优化以提高该激动剂Fc受体介导的交联活性。
目前国际上已有BMS研发的抗CD137激动剂单抗urelumab,在临床中显示出单药活性,但由于肝毒性十分明显,单药临床开发暂被搁置。而根据天演公布的数据,ADG206有望同时解决CD137激动剂抗体单药的安全性和活性两方面的担忧。
图2比较了掩蔽和去掩蔽处理的ADG206抗体与urelumab的T细胞激活活性。最上方的蓝绿色虚线代表去掩蔽的ADG206,红色线代表的urelumab, 最右边绿色线代表的掩蔽态的ADG206。在低浓度时,去掩蔽的ADG206引发大量IL2释放,这显示出其对T细胞强大的激活能力,同时也提示存在较高引发细胞因子风暴的风险;红色线代表的urelumab同样在低浓度时会导致机体T细胞释放较多细胞因子。但最右边蓝绿色实线代表的经掩蔽处理的ADG206,它在同样低浓度时,导致的细胞因子释放量很少。由此验证经过安全抗体设计的ADG206在正常组织中具备更好的安全性,而在进入特定肿瘤组织中被激活后也会有更高的抗肿瘤活性, 同时也不必担心系统性引发较高细胞因子风暴的风险。
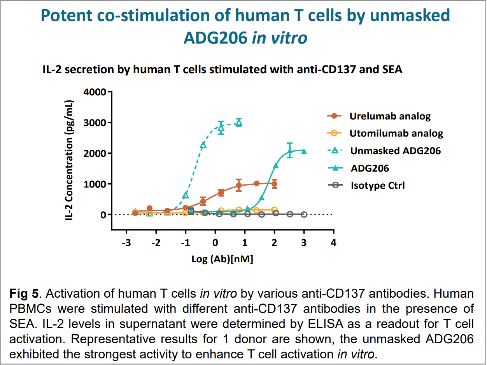
图2 ADG206对人T细胞的细胞因子释放的影响
AACR海报上的另一张图也展现出ADG206对CD137的激动活性。如图3右侧所示,在小鼠乳腺癌模型中,同样采用3mg/kg的用药剂量,黑色线代表的对照组肿瘤仍在生长,而蓝绿色线代表的ADG206对肿瘤起到明显抑制作用。
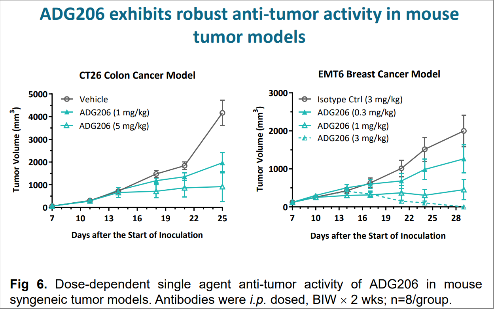
图3 ADG206在动物模型中的抗肿瘤活性研究
事实上,天演第一代基于IgG4的CD137单抗也已部分解决产品的安全性问题,此次二代产品将IgG4换成IgG1,目的即在于提高抗体Fc端的交联反应能力。从数据上看,ADG206单药活性确实得到提升,同时掩蔽肽的安全抗体技术也能较好克服因IgG1抗体交联活性可能诱发的毒性反应。
ADG153
另一个单抗针对的是CD47靶点,该靶点抗体此前主要存在红细胞毒性、抗原沉寂效应及抗肿瘤活性三个问题,ADG153的数据也重点展示拥有IgG1活性的安全抗体对这三方面的改进。
如图4,将ADG153对红细胞的影响与吉利德的CD47抗体Hu5F9-IgG4类似物进行比较,可以看到红色线代表的Hu5F9类似物在用药剂量10mg/kg时,即会导致实验猴体内红细胞计数显著下降,最大降幅达49%;而蓝绿色线代表的ADG153对红细胞影响程度较小,曲线相对平稳,即使将ADG153的剂量增大到30mg/kg时,影响仍然小于红色线。

图4 ADG153对红细胞影响减小
另外,图5对比了Hu5F9类似物和ADG153在体内的半衰期长短。可以看到红色线代表的Hu5F9类似物在进入猴子体内后很快被代谢清除,这主要是抗原沉寂效应导致(与CD47也在红细胞上大量表达有关)。而ADG153采用的安全抗体设计避免了抗原沉寂效应,使得产品半衰期较Hu5F9类似物提高8倍。
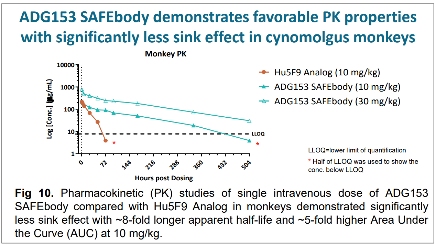
图5 ADG153的半衰期显著延长
海报也展示了ADG153的抗肿瘤活性(如图6),可以看到相同给药浓度下,ADG153的肿瘤抑制效果仍然好于Hu5F9类似物,这同样得益于天演的IgG1设计,较Hu5F9类似物的IgG4设计有更强的ADCP和ADCC效应。
 图6 ADG153的抗肿瘤活性
图6 ADG153的抗肿瘤活性
双掩蔽安全抗体
而安全抗体技术在双抗ADG138(HER2×CD3)上的使用,对抗体安全性的提升更加显著。其作为T细胞接合器,抗体的一端与肿瘤细胞HER2靶点结合,另一端与T细胞的CD3靶点结合,该设计原理可引导和激活T细胞对肿瘤细胞发挥强大的杀伤作用。
但既往这类双抗都有剂量依赖的细胞因子释放作用,这严重影响了抗体用药的剂量提升,也限制了抗体作用发挥,多个产品临床研究也曾因不良反应太大被FDA叫停。此前开发的产品仅在血液瘤治疗上取得了有限的成功,而在实体瘤上的应用没有明显突破。
在去年的美国血液学会年会(ASH)上,天演也公布过另一款双抗ADG152(CD20×CD3)的临床前数据,但该抗体只单屏蔽CD3结合臂,目标适应症是血液瘤;而ADG138实现HER2和CD3结合臂的双掩蔽,进一步降低正常组织的毒性以及细胞因子的释放,有望成为可用于实体瘤治疗的T细胞接合器产品。
从图7可以看到,未做掩蔽处理的ADG138,在单次给药0.2mg/kg用药剂量时即会引发大量细胞因子释放。据天演介绍,该实验猴子在12小时内死亡。而进行掩蔽设计的ADG138,在该实验中不论在10mg/kg、30mg/kg还是60mg/kg给药,引起的细胞因子释放都不明显,安全抗体设计解决了T细胞接合器的安全性问题。

图7 ADG138显著减少细胞因子释放
而疗效方面,图8显示ADG138在0.6mg/kg用药剂量时,即可看到肿瘤体积缩小,结合上述安全性研究的用药剂量,可得知其具备较大的安全用药窗口。同样采用0.4mg/kg的用药剂量,ADG138对HER2低表达肿瘤的抑制能力要好于曲妥珠单抗及HER2 ADC产品DS-8201。0.1mg/kg ADG138给药时,肿瘤就开始缩小,而其他产品在给药0.4mg/kg时,肿瘤仍在继续增大,而与溶媒对照组无显著差异。
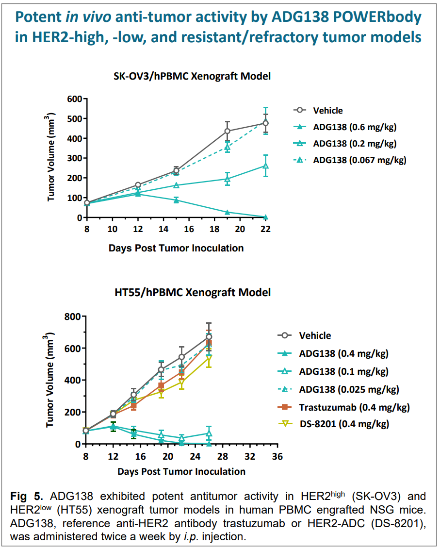
图8 ADG138的肿瘤杀伤作用
此外,天演也挑战了曾被认为抗体研发禁区的CD28靶点。CD28是T细胞上的另一可结合激活位点。但2006年CD28抗体TGN1412首次进入临床研究,就导致6个健康受试者在注射该抗体后的90分钟内产生危及生命的细胞因子风暴,为此开发该抗体的TeGenero Immuno Therapeutics也在一年后宣布破产。
此次,天演透露正在开发CD28抗体,说明其对安全抗体技术更加自信。据介绍,该产品选择了一个较为保守的跨物种交叉靶位。这也是天演的研发策略之一,靶向具备跨物种交叉反应的特殊表位,即可以前期在多种动物模型上更有效验证产品的安全性,以有效规避上述风险。
除了安全性和单药活性外,天演还在AACR海报上展示了产品相互联用或与PD-1抑制剂联用的效果,这部分数据亮点在于部分联用方案对免疫治疗反应较差的冷肿瘤和耐药肿瘤展示出抗肿瘤活性。
如图9,ADG206与PD-1抗体或天演的CTLA-4抗体联用,均展现出良好的肿瘤抑制能力,图中最下方深蓝色线代表的即联用效果,显示肿瘤生长得到更好的抑制。
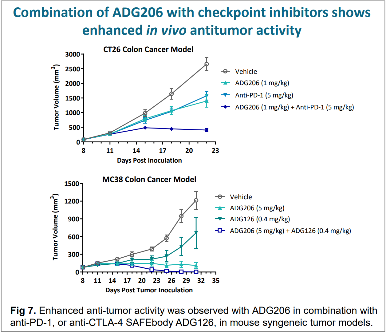
图9 ADG206(CD137)与抗PD-1抗体或ADG126(CTLA-4)的联用效果
而图10和图11 ,是ADG138(HER2×CD3)分别与抗CD137抗体、抗PD-1抗体以及CD28双抗的联用效果。这些数据展现出上述几款产品在治疗中的协同应用能力,尤其对于单药治疗难以起效的冷肿瘤,以及有多个机制可实现免疫逃逸的耐药肿瘤,联用起到了更好的肿瘤抑制效果。但同时,CD3与CD137的共刺激,以及CD3与CD28的共刺激,也存在更大引发细胞因子风暴的可能性,这也对产品安全性提出更高要求。

图10 ADG138(HER2×CD3)与CD137抗体或PD-1抗体的联用效果

图11 CD28双抗与AD138(HER2×CD3)的联用效果
抗体技术平台获国际广泛认可
随着产品数据连续在多场重要会议上发布,天演抗体平台在国际上已具声誉,近年时有大金额合作开发项目产生。
如今年3月与赛诺菲达成的研究合作,即利用天演的安全抗体技术为赛诺菲开发新一代单克隆与双特异性精准掩蔽型安全抗体,该合作首付款达1750万美元,可首先启动两款赛诺菲提供的抗体候选药物进行合作开发,而赛诺菲在另外支付相应的付款后,有权提名额外的两款候选抗体药物进行合作开发与商业化。后续天演还将有资格获得高达25亿美元的开发、申报和商业里程碑付款,以及产品全球净销售额的分级特许权使用费。
此外,还有多家国际制药企业之前已与天演建立合作关系(详见下表)。

在国内企业合作方面,天演也已完成两个产品的对外授权(授权大中华区),正由其合作伙伴负责开发中,它们分别是:处于临床Ⅱ期,由三金药业负责开发的抗 PD-L1 抗体 ADG104,以及处于临床Ⅰ期,由宝船生物负责开发的抗CSF-1R抗体 ADG125。
根据2021年财报,上述合作为天演带来多项特许权使用费收入。2021年,天演收入1020万美元,其中来自Exelixis合作的收入850万美元,来自宝船生物的合作收入120万美元。
在临床研究方面,天演与跨国制药企业也有合作正在进行。目前3款进入临床阶段的产品ADG116、ADG126及ADG106,均与默沙东的PD-1抑制剂帕博利珠单抗开展联合用药研究。此外,ADG106与BMS的PD-1抑制剂纳武单抗联用的IIT研究也在新加坡开展中。
2022年下半年,天演还将公布更多临床数据,包括ADG116/ADG126单药的剂量扩展以及与抗PD-1抗体联用的安全性及有效性数据。
综上所述,目前已公布的产品数据反映出天演抗体平台在靶点及靶位选择、抗体设计、动物模型开发等方面,已形成一套完整的策略,而当下天演的产品线布局以及与国内外公司和研究机构建立合作关系,正是在不断拓宽技术平台的应用领域。
可以看出天演在努力增加管线靶点的多样性,目前已公布数据的产品针对的靶点有8个,覆盖了多个肿瘤免疫治疗的关键性基础靶点,同时这些靶点也面临严重的临床安全性问题,如CTLA-4、CD137、CD3、CD28等。同时其也在拓展技术应用的深度,从单抗到双抗,从单掩蔽抗体到双掩蔽抗体。而借助外部合作,抗体平台的应用范围再度延伸至抗体偶联药物(ADC)以及CAR-T等公司内部产品开发未涉及的方向。
天演的模式让人联想到国外另一家同样以抗体平台技术见长的生物技术公司Genmab,该公司2021年收入达12.93亿美元,主要来自多款合作开发产品的特许权使用费贡献,其中与强生合作开发的CD38抗体达雷妥尤单抗2021年全球销售额达60亿美元。天演会是下一个Genmab吗?
总第1665期




















评论