美国紧急授权中国62家口罩厂商,我国医疗物资出口检验新政反转
面对仍在继续的新冠肺炎疫情,多国不断调整防疫物资进出口规定。比如,先前不接受中国标准口罩的美国,截至13日已对62家工厂位于中国的口罩生产商给予紧急使用授权。此外,我国关于医疗物资出口的规定也有变化,出口时不再需要产地检验和出口电子底账。

KN95、ZK601口罩均获准进入美国
美国食品药品监督管理局(FDA)官网更新的最新数据显示,截至4月13日,已经有62家生产工厂位于中国的企业所生产的口罩获得了FDA的紧急使用授权(EUA),其中包含KN95、ZK601等符合中国国家标准的具有颗粒物过滤效率的一类口罩。

在美国疾病预防与控制中心(CDC)官网明确公众在物资不足的情况下,可戴其他部分国家标准的口罩后,FDA于3月28日开启了对于个人防护装备的紧急使用授权,即未经美国国家职业安全卫生研究所(NIOSH)认证的口罩也可获准进入美国。但仅有3M公司在韩国、英国、新加坡、土耳其所设立的生产工厂所生产的部分型号口罩与Dromex公司在南非的生产的型号为1020的口罩位列首批名单之中。
直至4月3日,FDA才发文表示允许生产工厂位于中国的企业所生产的无NIOSH认证的口罩也可获得紧急使用授权。
有行业人士表示,获得FDA的紧急使用授权仅代表此口罩获准进入美国,美国医院方仍是更认可获得NIOSH认证的口罩。

值得注意的是,半个月前的3月28日,FDA为缓解美国医疗防护装备的短缺,紧急批准了欧盟和5个国家(澳大利亚、巴西、日本、韩国、墨西哥)认证的非N95口罩,但中国产的KN95口罩却未获紧急授权。
根据FDA文件,中国生产的口罩获得EUA授权,需要满足三个要求:
一是拥有一个或多个NIOSH(美国国家职业安全卫生研究所)认证产品的制造商,按照其他国家/地区的适用授权标准生产的其他型号的过滤式面罩呼吸器(FFR),FDA可以进行验证;
二是中国以外的其他地区授权的,FDA可以进行验证;
三是有独立的测试实验室出具的检测报告,能显示其产品性能符合适用的测试标的,FDA可以进行验证。
美国法律规定,未经FDA批准,美国之外生产的口罩和大多数医疗设备都不能进入美国市场出售。
医疗物资出口无需产地检验和出口电子底账
自10日海关总署发布第53号公告对“6307900010”等19个商品编号项下医疗物资实施出口商品检验新政以来,给医疗物资出口带来了更大的不确定性。好在,现在情况“反转”了。
4月11日,海关总署再次印发《海关实施出口医疗物资法定检验工作方案》的通知,对第53号公告作出权威解读。通知明确,对53号公告所列11类出口法检医疗物资企业通过单一窗口申报报关。不同于其他出口法检商品的是,此次新增法检出口医疗物资采取验证管理方式,无需实施产地检验,报关时无需出口电子底账,企业只需正常申报报关单即可。
附:
法检医疗物资出口快速通关检验指南
根据海关总署2020年第53号公告,自4月10日起,对“6307900010”等海关商品编号项下的11类医疗物资实施出口商品检验,共涉及19个HS编码(见下表)。之前,对出口检测试剂已实施卫生检疫。
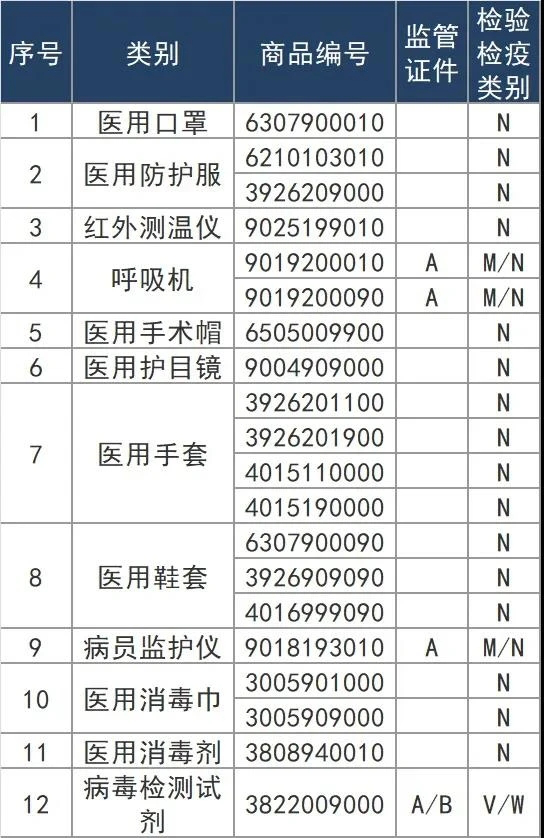
一、出口申报
对53号公告所列11类出口法检医疗物资企业通过单一窗口申报报关,不同于其他出口法检商品的是,此次对53号公告所列11类出口法检医疗物资企业通过单一窗口申报报关,不同于其他出口法检商品的是,此次新增法检出口医疗物资一般无需实施产地检验,报关时无需出口电子底账。
(1)对出口法检医疗物资,企业需在报关单商品名称栏填报用途,并注明是否医用,检测试剂需注明是否为新型冠状病毒检测用。
(2)对三部委“5号公告”所列(含公告后续调整所列)的出口新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计5类医疗物资,企业向海关报关时,须提供书面或电子声明和我国医疗器械产品注册证书。新冠病毒检测试剂还须提供药监部门出具的出口销售证明。
(3)对其他出口法检医疗物资,企业向海关报关时,应当提供医疗器械产品注册/备案证明和质量安全承诺声明。对无相关证明和承诺声明的,海关将实施严密监管。
(4)对新冠病毒检测试剂,发货人应当申请卫生检疫审批,凭《入/出境特殊物品卫生检疫审批单》通过单一窗口报检,经海关检验合格后,获得电子底账,报关时填写电子底账帐号。
二、质量安全要求
出口法检医疗物资应当符合进口国(地区)的要求,对进口国(地区)无质量安全标准要求的,应当符合我国质量安全标准。
三、装运前检验
按照中国和国外政府签订的双边协议,对出口至部分国家和地区的商品需申请实施装运前检验。


来源:华交会





















评论