一年烧掉6亿多,云顶新耀-B何日能“止血”?
智通财经APP了解到,3月22日,云顶新耀-B(01952)发布了2020年年报。财报显示,2020年,云顶新耀全年实现净亏损56.58亿元人民币(单位下同),主要由于向投资者发行金融工具公允价值变动产生亏损49.38亿元和IPO产生的费用2.78亿元。在非国际财务报告标准计量下,2020年全年云顶新耀净亏损6.02亿元,较2019年亏损1.63亿元相比,亏损幅度进一步扩大。
而导致2020年全年亏损大幅增加的一个重要因素是2020年公司的研发支出同比大幅提升,由2019年度的1.51亿元增加2.26亿元至2020年的3.77亿元。在强有力的研发投入下,公司当期研发管线也取得较好的进展。
或受业绩亏损大幅增加的原因,云顶新耀绩后股价表现不佳,截至收盘时间,公司股价下跌3.54%,报收79.00港元/股。
(行情来源:智通财经)
多点开花,研发管线全面推进
从云顶新耀的研发管线来看,公司所有引进的管线都是FIC和BIC类产品,对应的肿瘤、感染性疾病、免疫以及心肾四个领域,公司都已有相应的核心产品,分别为Trodelvy、eravacycline、etrasimod以及Nefecon。

Sacituzumab govitecan(Trodelvy)是公司肿瘤科的支柱产品,是同类首创的TROP-2靶向抗体药物偶联物(ADC),同时也是近期国际创新药领域的明星药。TROP-2是一种膜抗原,在许多常见的上皮癌中过度表达,现存TROP-2过度表达的癌症的总新发病例数超过350万,占2019年中国440万起癌症发病个案超过78.9%,因此Trodelvy可能具有广谱的抗肿瘤效果。
智通财经App了解到,Trodelvy的最初开发目的是治疗乳腺癌及尿路上皮细胞癌,但在多种癌症类型的病患中均表现出良好的临床效果,因此Trodelvy获美国FDA加速审批可用于治疗过往至少已接受两线转移性疾病治疗的转移性三阴性乳腺癌(mTNBC)患者,也是FDA批准的第一个Trop-2靶点ADC药物。
2020年4月,云顶新耀获得了Trodelvy的中国临床试验申请批准。目前mTNBC三线治疗的桥接注册性试验已在开展中,预计在今年Q3披露试验结果,随后递交BLA。
而针对3L HR+Her2-乳腺癌的3期临床申请已在2020年11月获批,目前正在中国大陆,台湾,韩国等地区开展一线多区域临床,计划入组330人。除此之外,公司还计划开展亚洲地区的一篮子研究,包括胃癌,食管癌,宫颈癌,NSCLC等。
除了Trodelvy外,公司在研的感染性疾病eravacycline(Xerava)是公司感染性疾病方面的核心候选产品之一,是一种新型全合成静脉给药的四环素类药物。Eravacycline对有多种耐药性(MDR)的及常见于中国的革兰氏阴性病原体(如肠杆菌目及鲍曼不动杆菌)展现出广泛及强大的体外抑制作用。
据弗若斯特沙利文报告,革兰氏阴性MDR抗生素市场为中国感染性疾病增长速度最快的市场之一,2019年的市场规模达人民币205亿元;2019年至2024年的复合年增长率为11.4%,2024年至2030年的复合年增长率为8.0%。
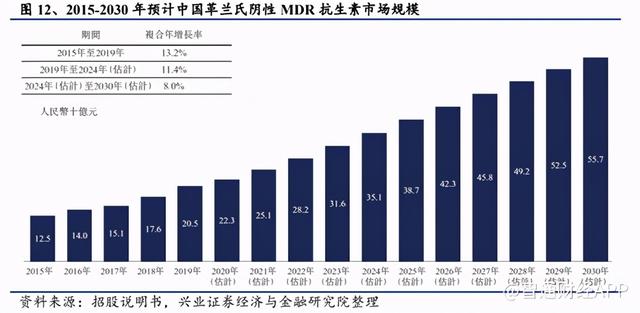
Eravacycline计划今年递交上市申请,预计明年H1获批。
在免疫学方面,公司的核心候选品之一则是Etrasimod,该药是第二代1-磷酸鞘氨醇受体(S1PR)1、4、及5口服调节剂。Etrasimod最初的适应症为溃疡性结肠炎(UC),但其后发现有机会适用于克隆氏症(CD)及自体免疫性皮肤病,这些疾病在中国被漏诊较多且治疗不足。
该药由Arena引进,目前海外正在开展用于治疗溃疡性结肠炎的三期临床试验。而国内方面,也正在进行溃疡性结肠炎的3期临床,计划入组330人,完整数据可能到2023年披露。
而关于AD适应症,Arena在2期临床并没有取得优效,但是Arena想要继续推进3期临床,云顶新耀将在今年决定是否加入AD适应症的3期临床。
最后,心肾疾病方面的核心药物是Nefecon,该药物是一款口服的布地奈德制剂,用于IgA肾病的治疗,从Calliditas引进。Nefecon的创新制剂让布地奈德可靶血递送至小肠中产生异常IgA抗体的部位,有助提升疗效及降低与全身使用布地奈德相关的副作用,是一种潜在首创用于治疗IgA肾病(IgAN)的候选药物。
2020年11月,Calliditas报告了全球3期临床试验NefIgArd A部分获得良好的关键性数据分析结果。2020年12月2日,中国国家药监局药品审评中心公示并在其后授予Nefecon为用于治疗IgAN的突破性治疗品种。
作为NefIgArd全球3期注册性研究的一部分,云顶新耀目前正在招募患者,以支持Nefecon在中国的注册审批。预期在2021年上半年完成NeflgArd用于IgAN的全球3期注册性研究的中国患者招募。
IgA肾病在国内的市场空间大,预计在220万人以上,但是目前没有有效疗法,预计Nefecon将会是首款获批上市的IgA肾病疗法。
亚太部分地区布局商业化
随着研发进度的不断推进,云顶新耀商业化也逐步提上日程。
云顶新耀将自己定位于亚太地区新兴市场的生物技术公司,因此大陆不是唯一市场,很多产品在东南亚和韩国等地区都有团队。公司也在电话会议中表示,台湾和新加坡地区都已经有相关领导上任,在韩国等地,对于Trodelvy这样的产品,不需要额外试验即可获批,因此,早日搭建销售渠道可进快给公司带来业绩,从而反哺其他产品在研产品。
除了销售以外,生产也是商业化重要的一环。年报显示,公司正在嘉善经济技术开发区建设符合美国FDA、欧洲药品管理局以及国家药监局标准的全球GMP工厂。同时公司在电话会议中表示,短期内会把Nefecon的生产引进国内,对于Trodelvy的生产,由于该产品生产工艺比较复杂,短期内可能还是由吉利德供应,吉利德能将成本降低到较低水平。不过最终云顶新耀还是会寻求在国内生产的机会。
总的来看,在上市的半年内,云顶新耀多款核心产品均有进展,尽管公司布局的几大领域均有重磅产品,但在国内市场,公司的几款核心产品离商业化仍较远,仍需投入较大的研发支出。不过由于其他亚太部分地区,无须做额外试验便可获批,因此公司也希望尽快搭建亚太地区部分的销售渠道,为公司尽快创造业绩。






















评论