盘点2021|吴小华教授:2021年度宫颈癌诊治年度进展

2021年度宫颈癌诊治年度进展
朱俊,吴小华(复旦大学附属肿瘤医院 妇瘤科,上海)
2021年尽管新型冠状病毒肺炎疫情仍在持续,但这并未阻挡抗肿瘤治疗的研究与进展。目前在全球范围内,宫颈癌仍然是女性最常见的恶性肿瘤之一,其发病率仅次于乳腺癌、结直肠癌和肺癌,位居第4位。GLOBOCAN 2020数据显示,全世界每年约有604 000例宫颈癌新发病例,其中有342 000例死亡病例。得益于对宫颈癌的早期筛查和人乳头瘤病毒(human papilloma virus,HPV)相关疫苗的普及,使得宫颈癌在早期能够得到确诊并诊治。而对于晚期甚至复发转移的宫颈癌患者,既往的治疗模式有限,但是得益于肿瘤靶向治疗和免疫治疗的推陈出新,使得这部分原本预后较差的患者获得了一定的生存获益。因此,对于晚期、复发或转移性宫颈癌患者,亟需更有效的治疗模式以达到缓解肿瘤的目的,并改善其生存预后。本文就2021年度晚期、复发或转移性宫颈癌诊治的重要研究进展作一概览。
局部晚期宫颈癌同步放化疗后辅助化疗的价值
自20世纪90年代以来,以顺铂为增敏的同步放化疗是局部晚期宫颈癌的标准治疗模式,此类患者的5年生存率为60%~66%。但是,部分患者即使接受标准放化疗后仍出现局部或远处转移。如何避免此类结局的发生、合理筛选这部分高危患者,以及是否有有效的干预方法以减少同步放化疗后出现远处转移成为了局部晚期宫颈癌患者的临床难点。既往一项Meta分析结果提示,对于局部晚期宫颈癌患者,接受标准同步放化疗后再给予一定周期数的辅助化疗可以显著提高患者的整体生存率。而后的一项临床研究报道了在同步放化疗后给予2个周期的卡铂联合吉西他滨化疗,可以使得3年无进展生存(progression-free survival,PFS)率和总生存(overall survival,OS)率提高9%。但是,也有一些临床研究并未发现辅助化疗对于局部晚期宫颈癌患者的生存获益。因此,局部晚期宫颈癌接受同步放化疗后再给予辅助化疗的价值仍需进一步探索。由ANZGOG(澳大利亚和新西兰)、NRG(美国、沙特阿拉伯、加拿大、中国)和新加坡等国家组成的妇科癌症组(GCIG)开展了国际多中心、随机、Ⅲ期试验(OUTBACK研究)[1],纳入更大样本以比较局部晚期宫颈癌接受同步放化疗后再给予辅助化疗的生存优势。
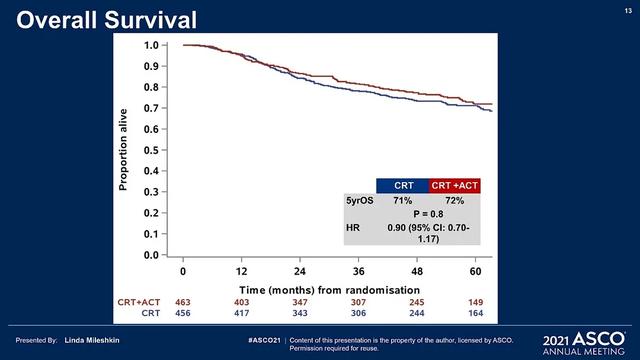
2021年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会公布的该研究结果引起了广泛关注。对于局部晚期宫颈癌患者,同步放化疗后辅助化疗能否延长复发时间和OS时间?OUTBACK研究为局部晚期宫颈癌接受同步放化疗后再给予辅助化疗的疗效提供了阴性结果。该研究旨在评估与同步放化疗相比,同步放化疗后行4个周期卡铂联合紫杉醇化疗能否改善宫颈癌患者的生存。入组对象为局部晚期宫颈癌患者[国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2008 ⅠB1期伴有淋巴结阳性、ⅠB2期、Ⅱ期、ⅢB期期或ⅣA]。在对淋巴结状态、参与地点、FIGO分期、年龄和计划扩大野放疗分层后,患者随机分入标准顺铂增敏的同步放化疗(对照组)或标准顺铂增敏的同步放化疗+卡铂/紫杉醇辅助化疗4个周期(ACT组)。主要研究终点是5年OS率,次要研究终点包括PFS率、不良事件以及疾病复发模式等。
2011年4月至2017年6月共招募926例患者,919例患者符合入组条件并纳入初步分析:ACT组为463例,对照组为456例。ACT组有361例(78%)患者接受了ACT治疗,中位随访时间60个月(IQR:45~65个月)。ACT组与对照组患者的5年OS率相似(72%∶71%,差异<1%,95%CI:﹣6%~+7%,P=0.91),OS风险比为0.91(95%CI:0.70~1.18);5年PFS率相似(63%∶61%,差异为2%,95%CI:﹣5%~+9%,P=0.61),PFS风险比为0.87(95%CI:0.70~1.08)。
随机分组1年内,ACT组中接受ACT治疗的患者中81%发生3~5级不良事件,对照组为62%。随机分组超过1年后,ACT组患者2级及以上周围神经毒性发生率高于对照组(7%∶2%),其他不良事件发生率比较差异无统计学意义。两组患者的疾病复发模式相似。研究结果提示:局部晚期宫颈癌患者接受标准顺铂增敏的同步放化疗后再给予辅助化疗不能改善OS或PFS。
图片来源:ASCO 2021
晚期、复发或转移性宫颈癌一线治疗模式的改变
对于经标准治疗后出现初次复发或转移的宫颈癌患者,其治疗方案有限,整体生存率低,5年生存率约为17%,既往指南建议化疗(联合贝伐珠单抗)作为其一线治疗方案,但化疗联合贝伐珠单抗的治疗效果有限。因此,寻找新的有效治疗方式能够为这部分患者带来新的希望。
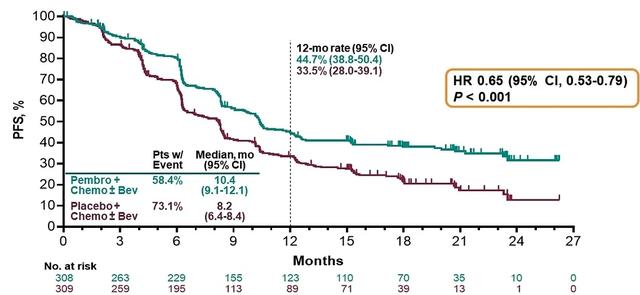
2021年ESMO年会报道的KEYNOTE-826研究结果[2],使得帕博利珠单抗联合化疗±贝伐珠单抗这一联合治疗模式有望成为持续性、复发性或转移性宫颈癌新的标准治疗方案。依据现有的指南,含铂化疗是持续性、复发性或转移性宫颈癌的标准治疗,而Ⅱ期研究KEYNOTE-158结果显示,帕博利珠单抗治疗接受过≥1线化疗、程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)阳性的复发性或转移性宫颈癌患者的客观缓解率(objective response rate,ORR)达到14.3%。Ⅲ期研究EMPOWER-Cervical 1/GOG-3016/ENGOT-CX9结果显示,相较于化疗,cemiplimab显著延长既往接受过≥1线化疗的宫颈癌患者的OS时间(中位OS时间为12.0个月∶8.5个月;HR=0.69,95%CI:0.56~0.84)。迄今为止,没有数据表明在化疗±贝伐珠单抗中加入程序性死亡蛋白-1(programmed death protein-1,PD-1)抑制剂可以改善持续性、复发性或转移性宫颈癌患者生存结局。
KEYNOTE-826研究为帕博利珠单抗联合化疗对比安慰剂联合化疗治疗持续性、复发性或转移性宫颈癌的随机、双盲、Ⅲ期研究,主要入组对象包括:不适合接受根治性治疗的持续性、复发性或转移性宫颈癌且未接受过系统化疗(允许接受过放疗或放化疗)。受试者经过1∶1随机入组至试验组(帕博利珠单抗联合化疗±贝伐珠单抗)和对照组(安慰剂联合化疗±贝伐珠单抗)。主要研究终点包括OS和PFS。截至2021年ESMO年会报告日期,该研究共纳入受试者616例(试验组307例,对照组309例)。研究结果显示,与对照组相比,无论PD-L1的表达状态[联合阳性评分(combined positive score,CPS)≥1、CPS≥10、意向性分析(intention-to-treat,ITT)人群],试验用药均能显著提高患者的PFS(P<0.001),降低死亡风险。同样,试验用药也可显著提高患者OS(P<0.001),且不论PD-L1状态。ITT人群中位OS时间为24.4个月,相较对照组延长约8个月,且降低死亡风险达33%;PD-L1 CPS≥1和PD-L1 CPS≥10患者中位OS时间尚未达到。对于PD-L1 CPS≥1、PD-L1 CPS≥10和ITT人群,其24个月OS率分别为53.0%、54.4%和50.4%。此外,该研究的次要终点ORR和缓解持续时间(duration of response,DOR)也得到了显著提高,其中ITT人群的ORR为65.9%,完全缓解(complete response,CR)比例为21.4%。在不良反应方面,试验组观察到的不良反应与PD-1抑制剂单药的不良反应一致。该研究表明,帕博利珠单抗联合化疗±贝伐珠单抗有望成为晚期、复发性、转移性宫颈癌一线治疗的新标准,且能够为患者提供持续安全的疗效。
KEYNOTE-826研究是帕博利珠单抗联合化疗用于一线治疗晚期、复发或转移性宫颈癌的关键性研究,是继帕博利珠单抗单药作为二线用药治疗复发、转移性宫颈癌的又一重大进展与突破。同时,KEYNOTE-826研究也为免疫疗法用于晚期、复发、转移性宫颈癌的一线治疗提供了进一步的支持。该研究也进一步为免疫治疗在复发、转移性宫颈癌中的作用提供了有力的循证医学证据,使得免疫治疗的应用线数得到了前移。
图片来源:ESMO 2021
晚期、复发或转移性宫颈癌的二线治疗新选择
在晚期、复发或转移性宫颈癌的二线治疗方面,既往国内外指南的推荐治疗以化疗为主,但疗效有限。而得益于免疫治疗在宫颈癌二线治疗中凸显的作用,目前美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南也推荐免疫治疗可用于晚期、复发宫颈癌,也使得免疫治疗正在成为晚期、复发宫颈癌临床治疗的主流方向。尽管KEYNOTE-028、Checkmate-358等多项研究提示了免疫治疗单药对宫颈癌治疗的有效性,但是整体缓解率等生存数据稍显薄弱,因此,越来越多的临床试验开始探索不同药物组合在晚期、复发或转移性宫颈癌二线治疗中的作用,也为宫颈癌免疫治疗的2.0时代拉开了序幕。
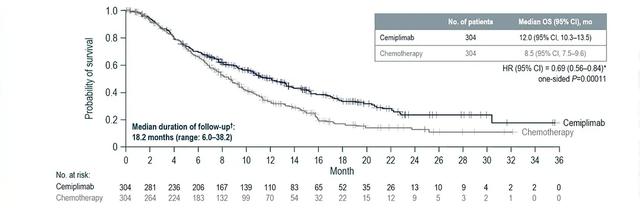
2021年ESMO年会报道的EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9研究,在复发/转移性(recurrent/metastatic,R/M)宫颈癌患者中比较cemiplimab与研究者选择(investigator's choice,IC)化疗的Ⅲ期试验结果为R/M宫颈癌的二线治疗提供了新方案,该药能够显著改善一线治疗后R/M宫颈癌患者的OS,cemiplimab有望跻身二线治疗[3]。
该研究是一项开放、随机、多中心的Ⅲ期临床研究。受试者为既往接受过含铂一线治疗后进展的R/M宫颈癌患者且不考虑PD-L1表达状态或组织学类型。随机按照1∶1的比例分别进入cemiplimab组(抗PD-1 cemiplimab治疗)和对照组(IC化疗,化疗方案包括培美曲塞、长春瑞滨、吉西他滨、伊立替康或托泊替康)。主要研究终点为OS。中期分析显示,试验共纳入608例患者,477例宫颈鳞癌患者,131例宫颈腺癌患者。这也是目前在R/M宫颈癌中开展的最大规模的临床研究。结果提示,与化疗相比,cemiplimab组患者的死亡风险降低31%(HR=0.69,单侧P=0.000 11)、疾病进展风险降低25%(HR=0.75,单侧P=0.00048),且ORR显著提高(16%∶6%;单侧P=0.000 04)。
图片来源:ESMO 2021
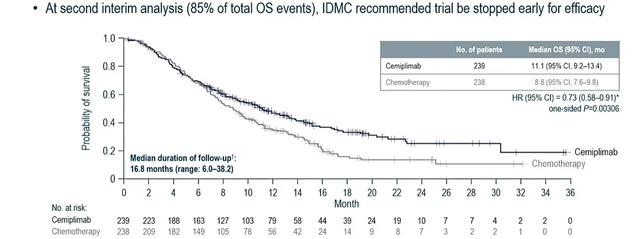
进一步依据病理类型的分层数据显示,在鳞状细胞癌患者中:cemiplimab组患者死亡风险降低27%,中位生存期为11.1个月,对比对照组(238例)为8.8个月(HR=0.73;95%CI:0.58~0.91;单侧P=0.003 06)。cemiplimab组患者的疾病进展风险降低了29%(HR=0.71;95%CI:0.58~0.86;单侧P=0.000 26)。且相较于对照组,cemiplimab组患者的ORR显著提高(18%∶7%)。同样的,在腺癌患者中:cemiplimab组患者的死亡风险降低44%,中位生存期为13.3个月,对比化疗组(66例)为7.0个月(HR=0.56;95%CI:0.36~0.85;名义单侧P<0.005)。相较于化疗组,cemiplimab组患者疾病进展风险降低9%(HR=0.91;95%CI:0.62~1.34),且ORR也有提高(12%∶5%)。在药物安全性方面,该研究中并未观察到cemiplimab用药的新型不良反应。cemiplimab组有88%的患者、化疗组有91%的患者出现用药相关不良事件。因此,在不考虑患者的PD-L1表达状态和组织学类型的情况下,与单药化疗相比,cemiplimab显著改善了含铂药物一线治疗后疾病进展的R/M宫颈癌患者的OS,并且未发现新的不良反应。
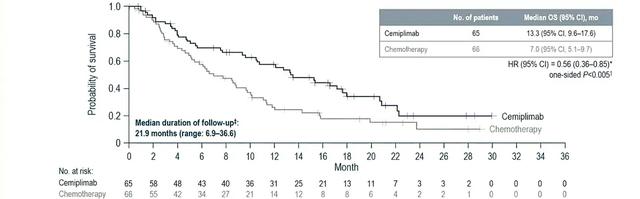
图片来源:ESMO 2021
Tisotumab vedotin(TV)是一种靶向组织因子(tissue factor,TF)的抗体药物偶联物(antibody-drug conjugate,ADC),既往临床前研究发现,TF在宫颈癌细胞中高度表达,可参与肿瘤生长、血管生成和转移。innovaTV201研究显示,TV在多种癌种中有较好疗效。2021年欧洲肿瘤内科学会(European Society of Medical Oncology,ESMO)年会报道了TV治疗复发或转移性宫颈癌的Ⅱ期研究(innova TV205/GOG-3024/ENGOT-cx8)的中期结果[4],该研究主要纳入接受标准治疗后进展的复发或转移性宫颈癌患者,分别入组三个研究治疗组,TV分别联合贝伐珠单抗(Arm A)或帕博利珠单抗(Arm B)或卡铂(Arm C),确定最大耐受剂量,并评估安全性与耐受性。一线TV+卡铂治疗队列疗效和安全性结果提示,ORR为18%,mPFS为9.5个月;在二线/三线TV+帕博利珠单抗治疗队列疗效和安全性结果显示,ORR为13%,mPFS为5.6个月。安全性分析显示大部分的不良反应为1级或2级,并无非预期不良事件。不论是TV+卡铂的一线治疗队列还是TV+帕博利珠单抗的二/三线治疗队列,均显示出令人鼓舞的抗肿瘤活性,在复发或转移性宫颈癌患者中的治疗前景令人期待。这些数据支持进一步研究以评估加入TV的其他联合方案作为复发或转移性宫颈癌的治疗选择,TV+帕博利珠单抗一线治疗的剂量扩展队列研究正在进行中,期待该结果在未来能够得到进一步的更新。
C550研究为balstilimab(PD-1抗体)联合zalifrelimab(CTLA-4抗体)作为一项治疗R/M宫颈癌患者的Ⅱ期研究[5],该研究主要入组含铂治疗后复发且组织学确认的宫颈鳞癌、腺鳞癌及腺癌患者。入组患者接受balstilimab 3 mg/kg每2周1次联合zalifrelimab 1 mg/kg每6周1次的治疗方案。截止至结果分析,共计125例患者可进行疗效分析。整体患者的ORR为25.6%,其中达到CR患者10例,达到PR患者22例。研究中位随访时间为21个月,mPFS时间为2.7个月(95%CI:1.5~3.7),mOS时间为12.8个月(95%CI:8.8~17.6);而PD-L1阳性患者亚组的mOS时间为15.7个月(95%CI:7.6~21.1)。在不良反应方面,大部分不良反应为1级或2级,并无非预期不良事件。
该研究是迄今为止最大的一项评估双免疫检查点抑制剂PD-1/CTLA-4在R/M宫颈癌中的疗效和安全性研究。balstilimab联合zalifrelimab组合获得了高且持久的应答率,表现出令人满意的总生存率和良好的耐受性。在PD-L1阳性患者中,balstilimab联合zalifrelimab疗效更显著。
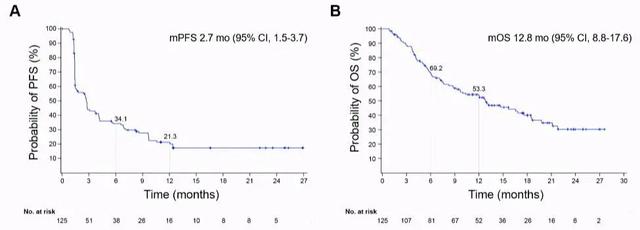
图片来源:ESMO 2021
安罗替尼联合信迪利单抗治疗复发性晚期宫颈癌患者的Ⅱ期研究[6]是中国的创新药在肿瘤治疗领域的突破。该前瞻性、多中心、单臂、Ⅱ期临床研究纳入受试者对象为接受过至少一线含铂化疗、经组织病理学确诊的复发性晚期宫颈癌(包括鳞状细胞癌、腺癌或腺鳞癌),并且经组织病理学证实的PD-L1阳性、ECOG 0~1分的患者。接受的治疗方案为:口服安罗替尼(10 mg qd,第1~14天,21 d为1个周期),信迪利单抗静脉给药(200 mg q3w)。治疗持续至疾病进展、死亡或出现不可耐受的毒性。主要研究终点为ORR,次要研究终点包括疾病控制率(disease control rate,DCR)、PFS、OS、安全性和生物标志物。结果显示,共计39例患者被纳入疗效评价群体。36例(85.7%)患者的ECOG PS评分为1分。此外,35例(83.3%)患者为鳞状细胞癌,25例(59.5%)患者既往接受过2种或3种化疗治疗,39例(92.9%)患者既往接受过放疗。患者的中位随访时间为10.9个月(0.03~19.2个月)。在ITT人群中,2例(4.8%)患者达到CR,21例(50%)患者达到PR;确认的ORR为54.8%。中位至缓解时间为1.71个月。此外,DCR为88.1%。在疗效评价人群中,ORR为59%,DCR为94.9%。中位PFS时间为9.40个月,6个月PFS率为73.1%。中位OS未达到。基于NGS研究发现,PIK3CA是队列中最常见的突变基因,发生在13例(31.7%)患者中,其中包括10例错义突变。9例(22.0%)患者FAT1发生突变,其次为PRKDC(8/41,19.5%)、KMT2D(7/41,17.1%)和ATR(6/41,14.6%)、PIK3CA单基因突变、PI3K-AKT信号通路相关的其他基因突变或KMT2D突变与更高的ORR显著相关(P<0.05)。相反,STK11突变与更低的ORR显著相关(P<0.05)。该研究是首个前瞻性抗PD-1抗体联合多激酶抑制剂治疗PD-L1阳性晚期/复发宫颈癌的研究,建立了安罗替尼联合信迪利单抗治疗晚期/复发宫颈癌的疗效和安全性数据。且针对宫颈癌基因突变图谱的全基因组分析将有助于建立一个包括晚期宫颈癌分子分层治疗相关的多种生物标志物在内的综合评估体系。
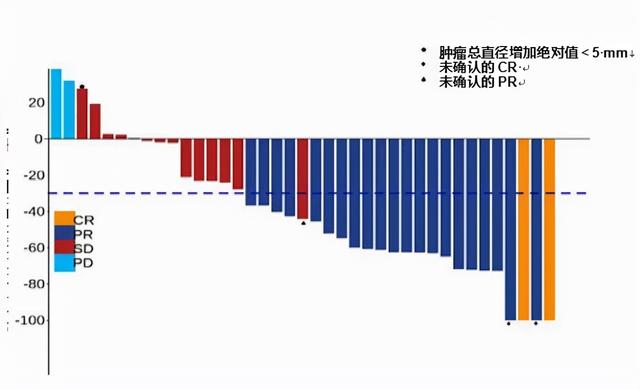
图片来源:ESMO 2021
除了靶向免疫检查点的抑制剂外,宿主对于肿瘤的主动免疫治疗也在不断地探索与研究。2021年ASCO年会报道了一项GX-188E(一种治疗性DNA疫苗)联合帕博利珠单抗治疗HPV16和/或18阳性的晚期宫颈癌患者的疗效和安全性结果:Ⅱ期KEYNOTE-567中期分析结果[7]。该研究入组了54例HPV-16或HPV-18阳性的晚期、手术无法治愈或转移性宫颈癌患者,这些患者既往均接受标准治疗且出现进展。研究评估了GX-188E联合帕博利珠单抗的疗效和安全性。根据研究者评估,GX-188E联合帕博利珠单抗治疗既往接受多次治疗的复发性宫颈癌,安全性和耐受性与帕博利珠单抗单药治疗相似,显著提高缓解率,达33.3%(16/48),PD-L1阳性、HPV16和鳞状细胞癌显示出更高的缓解率,其中PD-L1阳性患者为41.7%,HPV16患者为35.3%,鳞状细胞癌患者为33.3%;在PD-L1阴性、HPV18和腺癌患者中也观察到临床缓解。研究证明,GX-188E联合帕博利珠单抗治疗HPV16/18阳性的R/M宫颈癌,对标准治疗失败的患者是安全有效的。
HPV cfDNA作为晚期宫颈癌应答的生物标志物[8]
目前正在进行的宫颈癌免疫治疗相关的临床研究繁多,大部分研究仍处于试验的Ⅰ期或Ⅱ期阶段,Ⅲ期临床研究的数据较少。尽管从现有的数据来看,免疫治疗在宫颈癌治疗中取得了令人鼓舞的结果,但其报道的整体有效率尚不成熟,且多数有效患者的肿瘤组织PD-L1表达呈阳性。因此,对于晚期、复发或转移性宫颈癌患者,获取其足量有效的肿瘤组织标本仍然是此类患者治疗过程中所面临的挑战。HPV细胞游离DNA(cell-free DNA,cfDNA)在晚期宫颈癌中可能是一种独特的肿瘤标志物,但现有的数据有限。该研究主要目的包括研究HPV cfDNA的变化与临床结局之间的相关性。研究组包括21例转移性HPV相关宫颈癌患者,纳入了17例正在接受治疗的患者以及4例既往接受治疗目前观察中的患者,研究未接受治疗时的HPV动力学。针对与临床结局变化对应的时间点连续、前瞻性地采集血浆样本,使用Illumina NovaSeq进行HPV cfDNA基因分型和定量分析。HPV变化定义为每例患者的cfDNA水平较基线出现可定量的升高或降低。本研究还应用了定制的ctDNA panel,通过存档肿瘤的基因组测序确定的致癌突变。
研究结果提示,在大多数病例中,HPV动力学仍与临床结局密切相关(N=15/21),当观察到影像学上的疾病稳定时(N=4/21),HPV水平也发生了变化,但需要进一步的数据来证实HPV动力学是否可以较CT更早地预测结局变化。1例(007)患者HPV完全清除,继续接受治疗未复发。基线时所有患者的HPV ctDNA均能够进行基因分型、检测和定量。从基线至首次评估,在接受治疗的17例患者(Fisher精确P=0.015)和接受治疗或观察的所有患者(N=21)(Fisher精确P=0.001)中,HPV变化与临床缓解或进展相关。定制的ctDNA panel 能够检测到10例病例的突变,与相应肿瘤中发现的突变一致(不包括组织不足以进行分析的2例病例)。当用Spearman系数评估时,HPV的变化和变体等位基因频率(Variant Allele Frequency,VAF)的变化相关(rho=0.83,P=0.006)。当使用Fisher精确检验进行评估时,临床变化与VAF变化之间的相关性不具有统计学差异(P=0.05)。
这项初步研究结果显示,HPV cfDNA的动态变化与晚期宫颈癌的临床结局相关。HPV cfDNA在非侵入性HPV基因分型和治疗监测方面具有应用潜力,但需要在更大规模的研究中进行验证。
综上所述,宫颈癌的治疗始终遵循个体化标准治疗,HPV病毒感染与宫颈癌密切的关系使之能对免疫治疗有一定的疗效。随着肿瘤精准治疗的不断发展,现有的医疗手段和药物治疗将逐步完善既往治疗模式的局限与不足,靶向治疗和免疫治疗成为了宫颈癌治疗的“新方向”。2021年尚有不少值得回顾的亮点研究,宫颈癌治疗药物在不断开发与发展,越来越多的新药临床试验得到了陆续开展,期待有更多的阳性结果为宫颈癌患者带来获益,更期待即将到来的2022年,依托精准医学为基础,进一步指导临床治疗,为宫颈癌患者带来疗效和生活质量的双重改善!
参考文献:
1. Linda R, et al. Adjuvant chemotherapy following chemoradiation as primary treatment for locally advanced cervical cancer compared to chemoradiation alone: The randomized phase III OUTBACK Trial (ANZGOG 0902, RTOG 1174, NRG 0274). Journal of Clinical Oncology, 2021 39:18_suppl, LBA3-LBA3.
2. Colombo N, et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for persistent, recurrent, or metastatic cervical cancer: randomized, double-blind, phase 3 KEYNOTE-826 study. ESMO Congress, 2021, Abstract LBA2
3.Tewari KS, et al. VP4-2021: EMPOWER-Cervical 1/GOG-3016/ENGOT-cx9: Interim analysis of phase III trial of cemiplimab vs. investigator's choice (IC) chemotherapy (chemo) in recurrent/metastatic (R/M) cervical carcinoma. ESMO Congress, 2021.
4. Vergote IB, et al. Phase I/II trial of tisotumab vedotin plus bevacizumab, pembrolizumab, or carboplatin in recurrent or metastatic cervical cancer (innovaTV 205/ENGOT-cx8). Annals of Oncology, Volume 30, v433-v434.
5. O'Malley DM, et al. LBA34 Single-agent anti-PD-1 balstilimab or in combination with anti-CTLA-4 zalifrelimab for recurrent/metastatic (R/M) cervical cancer (CC): Preliminary results of two independent phase II trials. Annals of Oncology, Volume 31, S1164-S1165.
6. Xu Q, et al. 774P Anlotinib plus sintilimab in patients with recurrent advanced cervical cancer: A prospective, multicenter, single-arm, phase II clinical trial. Annals of Oncology, Volume 32, S752-S753.
7. Jong Sup Park, et al. Efficacy and safety results of GX-188E, a therapeutic DNA vaccine, combined with pembrolizumab administration in patients with HPV 16- and/or 18- positive advanced cervical cancer: Phase II interim analysis results (KEYNOTE-567). Journal of Clinical Oncology, 2021 39:15_suppl, 5511-5511
8. McMullen M. et al. Circulating human papillomavirus DNA as a biomarker of response in advanced cervical cancer. Annals of Oncology, Volume 32, S757-S758





















评论