Mol Cell | Hippo信号通路核心调控机制及肿瘤靶向治疗新策略
点评 | Hong Wanjin(洪万进,新加坡A*STAR)
Hippo信号通路参与肿瘤发生、发展、耐药等不同阶段,是一个理想的肿瘤治疗靶点【1】。近年来,开发靶向Hippo通路的肿瘤治疗策略已成为一个研究热点,但目前尚没有相关药物进入临床【2】。Hippo领域近二十年的研究主要聚焦于通路组分的鉴定及功能解析,分子机制研究则相对滞后【3】。显然,明确Hippo通路调控机制是研发分子靶向策略的重要基础。
Hippo通路核心部分是一个激酶级联反应:MST1/2激酶(Hippo)— LATS1/2激酶 — YAP/TAZ转录共激活因子【4】。多年来,MST1/2能够磷酸化并激活LATS1/2这一结论被广泛接受,但是很少有人关注MST1/2激活LATS1/2的具体分子机制。作为整个Hippo通路的枢纽,LATS1/2激酶发挥承上启下的作用,因此明确上游信号调控LATS1/2的分子机制是人为调节和利用Hippo信号强度的前提条件。
2022年4月15 日,复旦大学生物医学研究院/附属儿科医院余发星课题组在Molecular Cell杂志以长文形式发表了题为WWC proteins mediate LATS1/2 activation by Hippo kinases and imply a tumor suppression strategy的研究论文。该研究揭示了WWC蛋白家族(WWC1/2/3)在MST1/2激活LATS/2过程中的重要功能及分子机制,并基于此机制开发了SuperHippo迷你基因,后者能够特异激活LATS1/2并显著抑制多种肿瘤的发生。

该研究首次提出MST1/2-SAV1-WWC1/2/3-LATS1/2四元信号传递模型(图1,冰糖葫芦模型)。其中,WWC1/2/3直接同LATS1/2及SAV1结合,SAV1进而招募MST1/2。因此,WWC1/2/3发挥分子平台的作用,将Hippo信号通路核心元件聚集起来,提高激酶级联反应的效率。长期以来,WWC家族蛋白被认为是普通的Hippo通路上游调控因子(5)。然而该研究表明,WWC1/2/3在Hippo通路的核心地带,也就是MST1/2和LATS1/2之间,起到 一种“卡脖子”功效,因而WWC1/2/3蛋白水平同Hippo通路信号强度高度相关。
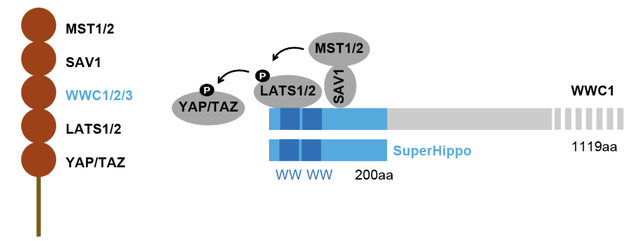
图1. WWC1/2/3介导MST1/2活化LATS1/2分子机制。
Hippo通路是通过大量的模式动物遗传筛选逐步建立起来的,该通路的成员基因的缺失导致细胞过度增殖和器官尺寸增大【3】。然而,不同的Hippo通路基因敲除后,表型强度并不一致。该研究基于分子机制创新,发现小鼠肝脏特异性敲除Sav1及Wwc1/2后,器官尺寸表型强度同Mst1/2敲除相似;另外,这两个基因型小鼠也在相似时间节点发生了肝细胞癌(HCC)。Hippo通路从果蝇到哺乳动物进化高度保守,该研究也在果蝇遗传学实验中得到了高度一致的结果。这一系列在体研究,一方面验证了分子机制,同时还发现了首个能够表型模拟Hippo激酶(MST1/2)缺失的基因型(Sav1及Wwc1/2共敲除)。
WWC家族蛋白同Hippo核心组分结合的关键结合位点集中在其N端(图1)。该研究发现WWC家族蛋白N端200个氨基酸序列能够有效激活LATS1/2。相关迷你基因(命名为SuperHippo)在小鼠肝脏中过表达后,表型和Hippo通路下游效应因子Yap/Taz敲除的小鼠表型十分相似。因此,SuperHippo转基因小鼠也是首个能够表型模拟Yap/Taz缺失的基因型。该研究还全面的检测了SuperHippo的抗肿瘤功效,发现SuperHippo显著抑制YAP/TAZ转录活性、在多种小鼠肿瘤模型中能够有效地抑制肿瘤发生发展(图2)。同已知的Hippo通路靶向方案相比,SuperHippo具有以下特色:1)是首个直接激活LATS1/2激酶的方法;2)功能完全依赖MST1/2及SAV1,具有非凡的特异性;3)用途广泛,不仅能够治疗Hippo通路失调导致的肿瘤,对胆管癌、肝细胞癌、葡萄膜黑色素瘤等肿瘤都有一定的效果。

图2. SuperHippo在多种小鼠肝癌遗传模型中显著抑制肿瘤发生
总之,该研究不仅揭示了Hippo通路上游核心组分的分子调控机制,还为开发靶向Hippo通路的肿瘤治疗方案提供了全新策略,在基础及转化研究层面都推动了Hippo领域的发展,为后续的研究提供了理论基础及应用工具。据悉,为了严格验证所提出的观点,本研究运用了大量、复杂的敲除细胞、果蝇及小鼠模型。匿名评审曾高度评价该工作:The protein and in vivo data presented in this paper are clean, robust and convincing. The finds are novel, interesting and scientifically relevant to the field.
复旦大学生物医学研究院2017级博士生祁思娴为本论文第一作者,余发星研究员为通讯作者。中国科学院分子细胞科学卓越创新中心张雷研究员,厦门大学周大旺教授及多位复旦大学教授对本文做出了重要贡献。
余发星课题组长期研究Hippo信号通路调控机制及功能(发育及肿瘤),以通讯作者形式在Cell,Molecular Cell,Cell Research,Cell Reports,Protein & Cell,EMBO Reports等期刊发表论文。课题组依托复旦大学生物医学研究院(IBS)和附属儿科医院,研究经费充足,现面向海内外英才,诚聘助理研究员、博士后及技术员若干,欢迎志同道合、热爱科研的朋友加入,长期有效。详情请见课题组网站http://yu-lab.fudan.edu.cn及IBS官网https://ibs.fudan.edu.cn。
原文链接:
https://doi.org/10.1016/j.molcel.2022.03.027
专家点评
Hong Wanjin(洪万进,新加坡A*STAR,Institute of Molecular and Cell Biology,Executive Director)
Hippo信号通路在器官发育及肿瘤发生过程中发挥重要功能。该通路主要包括一个线性的激酶级联反应,即上游激酶MST1/2在SAV1的辅助下磷酸化并激活LATS1/2,后者进一步磷酸化并抑制下游效应分子YAP/TAZ。YAP/TAZ作为原癌蛋白,参与不同肿瘤发生发展进程。因此,厘清Hippo通路信号调控机制,开发激活LATS1/2或抑制YAP/TAZ的方法,是肿瘤靶向治疗的新思路。然而,尽管Hippo研究领域在过去的15年里取得了巨大进展,MST1/2激活LATS1/2的具体分子机制仍然有待揭示。
复旦大学余发星团队最新的Molecular Cell论文阐述了WWC家族蛋白介导Hippo信号传递的重要分子机制。他们发现,WWC蛋白能够发挥“组织者”功能,在空间上将LATS1/2,SAV1和MST1/2富集到一起,介导MST1/2对LATS1/2的活化。他们定义了一个很小的WWC 蛋白结构域,负责直接结合LATS1/2 和 SAV1,后者间接招募MST1/2,从而促进Hippo信号高效传递。基于WWC蛋白的作用机制及鉴定出的最小化功能结构域,他们还开发了SuperHippo迷你基因,后者表达后能够直接激活LATS1/2进而抑制YAP/TAZ。在多种肿瘤模型中,SuperHippo展现了强大且特异的抗肿瘤功能。该工作综合运用了生物化学、细胞生物学和遗传学等多种技术手段,从多个角度、不同层次对提出的分子机制和功能进行了充分验证。
Hippo信号通路已经建立多年,很难想象MST1/2激活LATS/2这一个重要环节中还有如此精细的调控。该研究“于无色处见繁花”,提示Hippo领域还有很多科学问题值得深入探究,而传统的Hippo通路线性分子架构可能存在进一步优化空间。另外,作为分子机制创新促进临床转化研究的范例,SuperHippo的出现为随后肿瘤靶向治疗提供了新方向。余发星研究员早期的工作揭示了 GPCR 信号调节 Hippo 通路的现象和机制,而这一新的突破性发现清楚地表明,他领导的实验室在 Hippo 通路领域具有很强的国际竞争力。我向他、他的实验室成员和合作者表示最热烈的祝贺。
参考文献
1. F. Zanconato, M. Cordenonsi, S. Piccolo, YAP/TAZ at the Roots of Cancer. Cancer Cell29, 783-803 (2016).
2. R. Johnson, G. Halder, The two faces of Hippo: targeting the Hippo pathway for regenerative medicine and cancer treatment.Nat Rev Drug Discov 13, 63-79 (2014).
3. Y. Zheng, D. Pan, The Hippo Signaling Pathway in Development and Disease. Dev Cell50, 264-282 (2019).
4. F. X. Yu, B. Zhao, K. L. Guan, Hippo Pathway in Organ Size Control, Tissue Homeostasis, and Cancer. Cell 163, 811-828 (2015).
5. J. Yu et al., Kibra functions as a tumor suppressor protein that regulates Hippo signaling in conjunction with Merlin and Expanded.Dev Cell 18, 288-299 (2010).






















评论