钯催化的立体选择性高阶环加成制备「5.5.0」和[4.4.1
钯催化的立体选择性高阶环加成制备[5.5.0]和[4.4.1]双环化合物
本文来自微信公众号:X-MOLNews
中环化合物广泛存在于各种天然产物、药物分子中,特别是并环或桥接的[5.5.0]和[4.4.1]双环化合物,通常存在于生物活性分子中(如euglobal A(抗炎药)、psiguadial A(抗人类免疫缺陷病毒)、ingenol(抗癌)和cyclocitrinol家族)。然而,目前仍缺乏通用的策略来合成中环化合物,这主要是因为合成过程中存在着不利的跨环张力和熵效应。近年来,化学家们通过分子间高阶环加成反应来制备含中环的复杂多环结构,其中环庚三烯酮的环加成反应能够立体选择性地构建桥联或稠合的双环化合物。然而,该反应仅限于构建五(六)元环,很少有报道合成较大双环体系,唯一的一例是在手性胺催化下,环庚三烯酮对映选择性地进行[6+4]环加成反应来构建[4.4.1]单元(图1a,Nat. Chem., 2017, 9, 487–492; J. Am. Chem. Soc., 2018, 140, 13726–13735)。此外,还报道了分子内[5+2]环加成反应来构建更具挑战性的并环[5.5.0]或桥联[4.4.1]双环化合物(图1b、1c)。
众所周知,环庚三烯酮能以不同的形式(如2π、4π、6π、8π)参与环加成反应,从而导致混合的产物。于是,新加坡国立大学的赵宇教授课题组设想能否用催化剂来控制发散合成,这样就能得到不同骨架的中环化合物?近日,他们和重庆大学的蓝宇教授、云南大学的邵志会教授合作,报道了钯催化的环庚三烯酮与γ-亚甲基-δ-戊内酯的高阶环加成反应,立体选择性地合成了三类中环化合物(图1d)。机理研究和DFT计算表明发散性合成源于非对映异构中间体的不同反应,即当一个化合物通过O-或C-烯丙基化得到[5.5.0]或[4.4.1]双环化合物时,另一种非对映异构体的独特构型则可实现非常规的烯烃异构化,从而得到含桥头烯烃的双环[4.4.1]化合物。相关成果发表在Nature Chemistry 上。
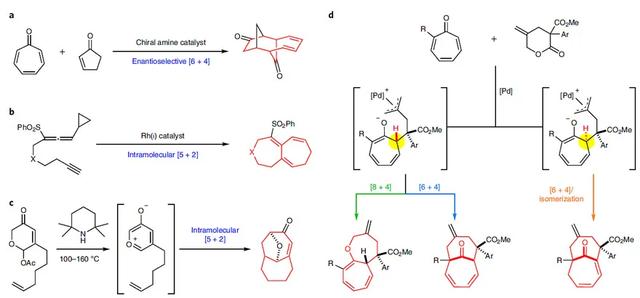
图1. 双环[5.5.0]和[4.4.1]化合物的合成。图片来源:Nat. Chem.
首先,作者选择γ-亚甲基-δ-戊内酯2a和环庚三烯酮1a作为反应底物(图2a),在Pd2(dba)3⋅CHCl3和亚磷酸三异丙酯(L1)的作用下,不仅得到[6+4]环加合物4a和[8+4]环加合物3a,还得到了一种含有桥头烯烃的[6+4]环加合物5a。这三种产物都具有优异的非对映选择性(> 20:1 d.r.),但是由于三种产物的比例不好(5:3:2)导致产率较低。于是,他们筛选了一系列金属前体和配体,最终发现DBFphos(L2)有利于生成3a(–20 °C下分离产率为88%,> 20:1 d.r.;条件A);dppf(L3)有利于生成4a(室温下收率81%,> 20:1 d.r.;条件B)。由于非手性配体不利于5a的生成,因此在缓慢加热下使用大位阻配体L4,以65%的收率、5:1 d.r.(条件C)得到5a。接下来,作者进行了详细的机理研究。首先,在优化的条件下监测了4a形成的反应曲线。如图2b所示,在最初的8h内,底物1a被完全消耗,主要生成3a(而不是4a),并伴有17%的5a。随着时间的流逝,3a 减少,4a逐渐生成,而5a的量基本上保持恒定。这些结果表明3a/4a和5a是通过两种不同的途径进行的。于是,他们选择p-OMe取代的化合物3b、4b、5b,并研究它们之间的相互转化(图2c)。在条件B下,3b可以完全转化为4b(收率:85%),但需要钯催化剂才能进行,并且没有发生4b→3b的反向转换。这些结果表明3b是通过[8+4]环加成反应形成的动力学产物,它可以通过Pd催化的逆向O-烯丙基化、C-烯丙基化进一步转化为热力学更稳定的[6+4]环加合物4b。进一步的研究表明另一种[6+4]环加合物5b不能转化为3b或4b。作者认为这可能与非对映异构中间体有关。于是,他们设法从p-OMe取代的δ-戊内酯反应中分离出一个非对映异构体3b'。值得一提的是,在相同条件下(条件B),3b'可以> 90%的产率转化为5b,且没有观察到3b或4b(图2c),这表明该反应最初形成的非对映异构中间体具有不同的反应活性。

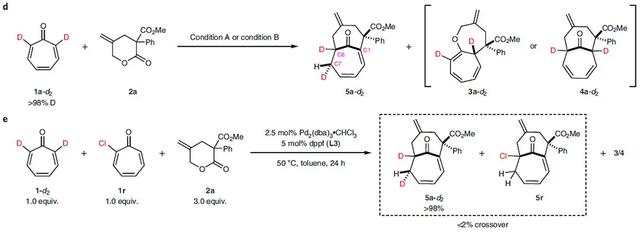
图2. 双环体系发散合成的发现及机理研究。图片来源:Nat. Chem.
为了阐明5的形成机理,作者制备了1a-d2,并将其置于条件A和条件B下进行反应(图2d),结果显示条件A下获得5a-d2和3a-d2,条件B下得到5a-d2和4a-d2。一维氢谱和NOE谱显示3a-d2和4a-d2中氘的位置保持不变(均在α-位)。相反,氘从C1移到C7时,5a-d2中的二烯发生了移位,并且C7上的氘仅在羰基桥的背面(> 20:1 d.r.),这暗示着同面氢原子转移机制。此外,1a-d2和1r进行交叉实验并没有观察到交叉产物5(图2e),进一步支持了分子内同面氢原子转移。
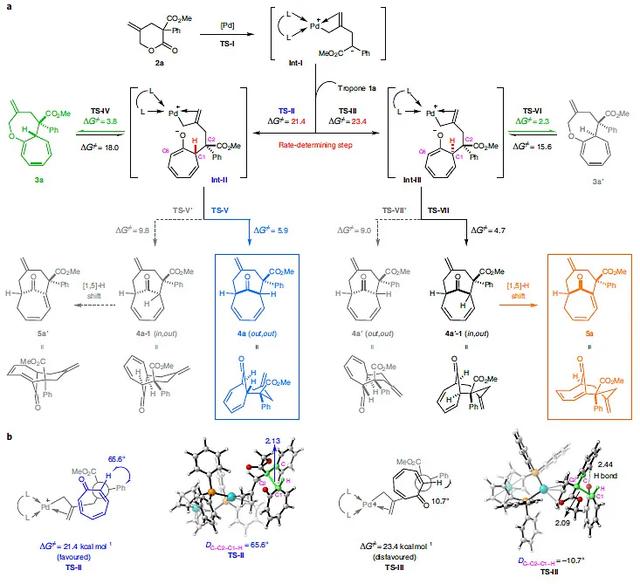
图3. 可能的机理及DFT计算。图片来源:Nat. Chem.
如图3a所示,作者提出了可能的反应机制。在内酯2a脱羧形成Pd-π-烯丙基Int-I后,Int-1上的碳原子进攻1a,生成了两个非对映的两性离子(Int-II和Int-III),随后通过不同的途径实现不同的环加成。。DFT计算显示Int-II(TS-II)中Int-1上的苯基与1a的α-H之间的扭转角为65.6°,而TS-III中相应的扭转角仅为10.7°。使得TS-III的自由能更高(比TS-II的自由能高2.0 kcal mol-1),且远高于其他过程。因此,Int-I对1a的亲核进攻是该反应的决速步。此外,两性离子Int-II中的O和C6均可作为亲核试剂与亲电的Pd-π-烯丙基进行反应。DFT计算显示O-烯丙基化在动力学上最有利,得到[8+4]环加合物3a。由于该步骤在钯催化下是可逆的,因此通过C-烯丙基化得到热力学上更稳定的[6+4]环加合物4a。对于5的形成,DFT计算显示Int-II或Int-III的C-烯丙基化可能会以syn-或 anti-进攻,得到out,out(两个桥头质子朝外)或in,out异构体。事实上,Int-II更倾向于syn-进攻得到动力学和热力学均稳定的out,out-4a;而Int-III在动力学上更倾向于anti-进攻得到in,out-4a'-1。由于in,out-4a'-1的桥头氢原子靠近C7且环张力较大,因此有助于快速、立体保持的1,5-H迁移得到更稳定的环加合物5a。
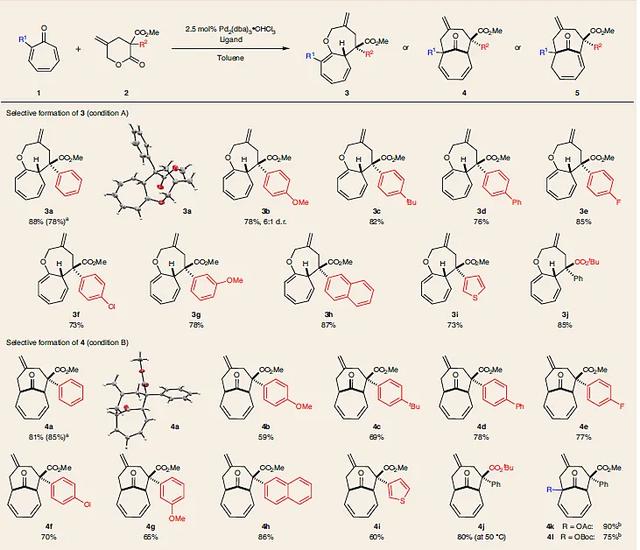
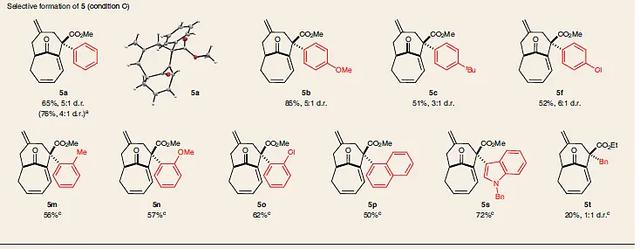
图4. 化合物3、4、5的范围。图片来源:Nat. Chem.
随后,作者对反应的底物范围进行考察(图4)。首先,在条件A或B下,能够以较好的收率和非对映选择性制备对位和间位芳基、杂环、叔丁基酯取代的双环[5.5.0]或[4.4.1]产物(3a–3j和4a–4j),其中3a和4a能以1 mmol规模进行制备。对于2-乙酰氧基和2-叔丁氧羰基取代的tropones,也能以优异的收率(分别为90和75%)和非对映选择性(> 20:1 d.r.)得到相应的[4.4.1]双环产物4k和4l。其次,在条件C下,对位芳基取代的各种内酯2也能兼容该反应,以良好的收率得到主要产物5a-5c和5f,尽管非对映选择性适中(3:1-6:1 d.r.)。出乎意料的是,当使用大位阻取代(如邻位取代的芳环或1-萘基)的内酯2时,在条件B下得到5(而不是4),且具有优异的非对映选择性(5m-5p)。杂环取代的2s也可以参与反应,但是烷基取代的内酯2t则以低收率和d.r. 得到5t。在此基础上,作者开始探究不对称转化(图5)。在筛选了不同的手性配体之后,单膦配体(R)-SITCP能以82-88%e.e.得到4a和5a,尽管比例接近1:1,但可以很容易地将其分离,收率分别为48%和42%。各种供电子基和吸电子基取代的内酯2都可以兼容该反应,以中等的收率和较好的对映选择性(80-90%e.e.)得到4(4b、4c、4f)和5(5b、5c、5f)。此外,通过减少反应时间可以实现动力学产物双环[5.5.0] 3。如图5所示,当40min后停止反应时,同时得到3a(e.e.:82%,产率:49%)和5a。值得注意的是,3a的对映体纯度略低于4a。

图5. 化合物3、4、5的不对称合成。图片来源:Nat. Chem.
作者还考察了环庚三烯酮的底物范围。苯基、乙酰氧基、叔丁氧羰基和氯取代的环庚三烯酮都可以顺利地进行环加成反应,并且倾向于形成桥头烯烃双环5(收率55-70%;d.r.:4:1-20:1;e.e.:80-88%)。为了生成更具挑战性的双环化合物5,他们使用2-氯取代的环庚三烯酮进一步考察了内酯的底物范围。无论芳环的对位带有何种取代基,都能以较好的收率(54-75%)和对映选择性(81-85%e.e.)得到单一的非对映异构体5ra-5re。同样地,间位取代的芳基、2-萘基以及噻吩也具有良好的立体选择性(5rf-5ri,> 20:1 d.r.;67-85%e.e.)。值得一提的是,通过一次重结晶便可进一步提高5q和5rh的对映选择性(e.e. > 99.5%)。

图6. 化合物3、4、5的衍生化。图片来源:Nat. Chem.
最后,作者对化合物3-5进行了多种转化。如图6所示,当用原位生成的苯炔处理[5.5.0]双环3a时,在环外烯烃上进行ene反应,得到三取代的环内烯烃6a。使用标准的Pd/C体系对4a和5a进行氢化,可以较好的非对映选择性(> 20:1 d.r.、10:1 d.r.)得到7a和8a,且8a中反应性较低的桥头烯烃保持完整。此外,作者还尝试立体选择性地还原4a和5a中的羰基桥,有趣的是,在羰基还原后进行了分子内酯化,得到多环内酯9a和10a。使用甲醇钠作为亲核试剂,也可以进行类似的转化,以优异的收率得到单一的非对映异构体11a和12a。
总结
本文发展了一种Pd催化的环庚三烯酮和γ-亚甲基-δ-戊内酯的高阶环加成反应,可合成三类中环化合物(双环[5.5.0]dodecatrienes、双环[4.4.1]undecadienes和含桥头烯烃的[4.4.1] 环)。该反应不仅条件温和、原料简单易得、底物适用性广,产物还可以进一步转化为一系列中等大小的双环和多环化合物。
Stereoselective access to [5.5.0] and [4.4.1] bicyclic compounds through Pd-catalysed divergent higher-order cycloadditions
Li-Cheng Yang , Ya-Nong Wang , Ruoyang Liu, Yixin Luo , Xiao Qian Ng , Binmiao Yang, Zi-Qiang Rong, Yu Lan , Zhihui Shao, Yu Zhao
Nat. Chem., 2020, 12, 860-868, DOI: 10.1038/s41557-020-0503-7





















评论