普瑞研究院:泰国&新加坡医疗监管信赖突破性进展,加速注册流程
第一节
新加坡HSA -泰国FDA 监管信赖试点项目
2022.06.01 公共卫生部泰国食品药品管理局(Thai FDA)医疗器械控制司发布公告,自 2022年6 月 1 日起对风险分类为 2-4 或 B-D的体外诊断医疗设备(IVD) 或非体外诊断医疗器械 (Non-IVD) 实施泰国 FDA – HSA 新加坡监管信赖计划。

泰国 FDA - HSA 新加坡监管信赖是监管机构之间的一项加速医疗器械注册计划,向制造商或进口商提出缩短注册期限的提议。由于泰国 FDA 医疗器械控制部已被新加坡卫生科学局机构认可为参考机构,在该计划中,泰国 FDA 将与卫生科学局机构合作评估医疗器械的性能和安全性,新加坡的评估报告。即已获得 HSA医疗器械许可证并希望参与监管信赖计划的新加坡注册人可以允许 HSA向泰国 FDA 提交医疗器械评估报告。
参与条件
1. 在新加坡注册的医疗器械,以及
2. 作为体外诊断医疗设备 (IVD) 或非体外诊断医疗器械 (Non-IVD) 的风险分类 2-4 或 B-D。
优点
1.降低泰国FDA注册费,专家评审过程,最高可免除 53,000 泰铢的费用(取决于其风险分类);
2、技术文件审核时间周转时间将从 150 个工作日减少到 60 个工作日。
操作步骤
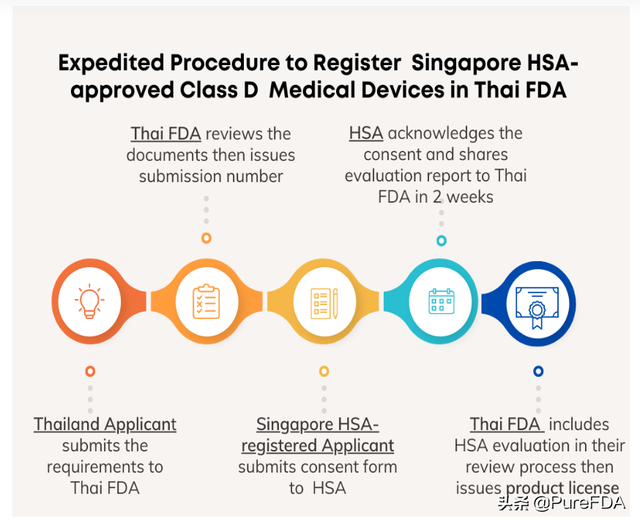
1.提交参与监管信赖计划的申请信;
2. 制造商或进口商通过电子版提交医疗器械许可申请,需要提交文件如下:
1) 以通用提交技术文件模板 (CSDT) 形式的注册文件,即与用于在 HSA 机构注册的CSDT 文件相同,
2) 经HSA机构授权的变更通知文件(如有),
3) 要求参与监管信赖计划的申请信,
4)新加坡HSA批准医疗器械注册证明。
3. 在电子提交系统中收到申请号后,新加坡的注册人(拥有 HSA 的医疗器械许可证的公司)签署泰国 FDA 和新加坡 HSA Reliance 同意书范本 (Consent Form) 允许 HSA 向泰国食品和药物管理局医疗器械控制司提供医疗器械提供评估报告。
4. 泰国 FDA 官员将请求发回给制造商或进口商并附上电子提交系统中的同意书。

其实新加坡 HSA-泰国 FDA 监管信赖试点项目早在几年前就启动了。为探索解决监管机构面临的新技术发展等挑战,并加强患者获得医疗器械的机会,新加坡 HSA 和泰国 FDA 在亚太医疗技术论坛 (APACMed) 的支持下,在双方建立信任后于 2020 年 9 月启动了监管信赖试点项目。
在 COVID-19 大流行之前,泰国 FDA 能够派遣三名评估人员在新加坡与 HSA 共度两周,以熟悉 HSA 的评估方法。作为该项目的一部分,该试点项目也是 HSA 和泰国 FDA 为能力建设目的就目标类别的医疗器械交换信息的机会。在试点项目开始之前,HSA 与泰国 FDA 签署了保密协议,以允许两个当局自由地相互分享提交相关信息。
2020 年 9 月该项目实施第一阶段试点,泰国 FDA 提议以先到先得的方式接受 12 份申请。该试点对整个行业开放。
2021年8月,泰国 FDA 发布公告,泰国 FDA 已被新加坡卫生科学局机构认可为参考机构,在此计划中,泰国 FDA 将与新加坡卫生科学局机构合作评估医疗器械的性能和安全性,出具评估报告。这是首次全面开放,参与条件为:
1. 已在新加坡注册的医疗器械,以及
2.风险分类为4或D的体外诊断医疗设备 (IVD) 或非体外诊断医疗器械 (Non-IVD)。
2022年6月,泰国 FDA 再次发布公告,将监管信赖计划的适用产品范围拓展到风险分类为 2-4 或 B-D 的体外诊断医疗设备 (IVD) 或非体外诊断医疗器械 (Non-IVD)。
第二节
监管信赖的起源
监管信赖的概念最先由世界卫组织WHO提出,其在2020年6月出版的《医疗产品监管中的良好信赖实践:高级原则和考虑》中定义了监管信赖的各种概念。监管信赖是指权威机构(“信赖机构”)完全或部分信赖另一个市场(“参考机构”)或受信任的机构(如世界卫生组织 (WHO))做出的评估和/或决定对于医疗产品的审批。
监管信赖的最基本形式是利用另一个监管机构已经完成的工作来支持决策过程并保持医疗产品批准的独立性。更高级的信赖形式是正式接受另一个监管机构根据条约或相互承认等协议做出的决定,而无需重复任何评估。
监管信赖的必要性
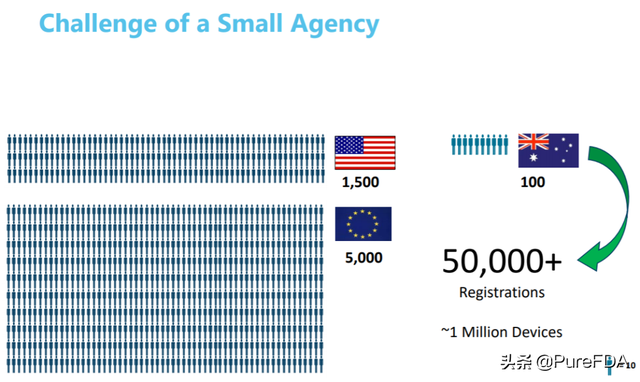
1. 监管机构压力,尤其是小的监管机构
2. 新技术的发展

3. 公共卫生安全的威胁

我们已知的监管信赖计划有医疗器械单一审核计划 (MDSAP,Medical Device Single Audit Program),该计划允许对满足多个监管管辖区要求的医疗器械制造商的质量管理体系进行单一监管审核。审核由参与的监管机构授权和认可的审核组织进行,以根据 MDSAP 要求进行审核。泰国-新加坡的监管信赖项目也是一个典型示范。
考虑到每个国家或者区域法律,法规的相似性以及差异的识别,评估如何去鼓励国家或者区域间的信任,以及策略的优先级,完全的监管信赖是很难的。但是,如果我们想提高效率和获得健康产品的机会,我们都必须优先考虑监管信赖,即使是部分信赖。























评论