《Chem》无光产生单线态氧!pH响应化学发光的纳米颗粒
【背景介绍】
在足够的H2O2存在下,基于Fenton或Fenton样反应的活性氧(ROS)生成的化学动力疗法(CDT)为癌症治疗提供了另一种机会。与其他癌症治疗方法(例如化学疗法,放射疗法或光动力疗法)相比,CDT具有更高的选择性,并且可以被内源性刺激(例如酸度和H2O2)激活。该过程在一定程度上防止了正常组织的损伤,因为该反应在正常细胞的微环境中被有效地抑制了。尽管已经采用了许多策略来促进CDT的有效性,包括选择/修饰纳米材料和优化反应过程,但仍需要开发具有高效率产生ROS的新型化学动力学反应。不出所料,CDT期间高效的ROS产生可能带来更好的治疗效果;但是,它通常会增加损坏周围正常组织的风险。因此,在治疗过程中执行ROS生成的实时监控以进行精确给药(例如精确的注射剂量或间隔)非常重要。

【文献摘要】
在CDT中,迫切需要新颖的化学动力反应来提高活性氧(ROS)的产生效率,同时对ROS进行实时监测对于最大程度地降低CDT的毒副作用至关重要。先前,湖南大学宋国胜/新加坡南洋理工大学浦侃裔教授团队开发了一种pH响应的化学发光和化学动力学系统(超分子Mn氧化物[MnOx]纳米片-半导体聚合物纳米颗粒[SPNs])。相关论文Light-free Generation of Singlet Oxygen through Manganese-Thiophene Nanosystems for pH-Responsive Chemiluminescence Imaging and Tumor Therapy发表在《Chem》上。他们首次发现超薄MnOx纳米片在酸性触发下产生1O2的能力。值得注意的是,由MnOx产生的1O2可以替代光,并特别激发基于噻吩的SPN发出光子以用于近红外化学发光成像,从而大大放大了1O2的产生。由于肿瘤内固有的酸性,MnOx-SPNs实现了针对实体瘤的可激活化学动力学疗法。此外,比例化学发光/荧光成像能够校准1O2的输出,并在治疗过程中实现对1O2产生的实时和原位实时监测。

【图文解析】
组织开发了一种可激活的治疗和监测系统,该系统由超薄MnOx纳米片和SPN组成(示意图1)。组织提出了超薄MnOx((MnII)1(MnIII)3.4(MnIV)2.8O11.7)在酸性触发下产生1O2的能力,这是一种新颖的化学动力学过程。通过筛选半导体聚合物,发现超薄MnOx纳米片刺激了基于噻吩的SPN发出化学发光(CL)。在探索CL机理之后,组织发现MnOx产生的1O2与SPN中的噻吩单元反应,从而激发SPN发出近红外(NIR)CL,从而进一步放大了1O2的产率。在肿瘤固有酸性的激活下,MnOx-SPNs系统在体内外取得了令人满意的化学动力学治疗效果。此外,CL /荧光(FL)的比例成像可以校准1O2的输出,以便更准确地就地监测治疗的化学动力学过程。

示意图1. pH响应性1O2生成和CL的示意图,以及按比例的CL/FL成像监测癌症治疗
用于产生1O2的超薄MnOx纳米片的合成
二维MnOx超薄纳米片是通过用NaBH4直接还原KMnO4制备的(图1A)。透射电子显微镜(TEM)图像显示出其超薄的片状结构(图1B),并通过原子力显微镜(AFM)测量了1.2 nm的厚度(图1C)。所制备的MnOx可以很好地分散在DLS尺寸为25 nm的水中。射线光电子能谱(XPS)光谱表明MnOx纳米片由MnII,MnIII和MnIV组成,比例为1:3.4:2.8(图1D)。随着pH值的降低,SOSG的荧光强度逐渐增加,表明酸性激活了1O2的产生(图1E)。 MnOx与2,2,6,6-四甲基-4-哌啶酮(TEMP)(在pH = 4.4中)的孵育产生典型的1:1:1峰值信号,表明生成了1O2。ESR信号增加,表明1O2的产率更高;此外,降低的GSH被用作1O2的清除剂,并显着降低1O2的ESR信号(图1F),这些数据证明MnOx在酸性环境中产生了1O2。为了深入了解产生1O2的机理,与那些用灭活的超氧化物歧化酶(SOD)或不使用SOD的MnOx相比,诱导了SOD,它可以减少MnOx产生的1O2的ESR信号(图1G)。此外,1O2探针SOSG的FL随着MnIII离子浓度的增加而增强,并且在延长孵育时间的情况下也出现了这种增强(图1H)。

图1.超薄MnOx纳米片的表征及其产生1O2的能力.
pH响应CL成像的SPN的筛选
有趣的是,组织发现超薄MnOx纳米片可以刺激具有特定结构的SPN发出CL。在两亲性聚合物(聚(苯乙烯-马来酸酐)[PSMA])存在下,采用纳米沉淀法将7种半导体聚合物分子转化为水溶性纳米颗粒(图2A和2B)。在酸性条件下(pH = 4.4)将那些SPN与MnOx一起孵育,并在生物发光模式下(无激发)通过IVIS光谱成像系统收集CL信号。作者发现只有那些含有噻吩单体的SPN(例如PFODBT和TTFQx)才会显示明显的CL信号(图2C)。令人惊讶的是,将MnOx与基于PFODBT的SPN在酸性(pH = 5.4)中孵育会立即产生强CL。仅从MnOx或SPN观察到信号(图2D)。此外,基于PFODBT的SPN与其他氧化底物或离子(ONOO-,H2O2,O2-·,·OH,Fe3+,Cu2+,Mn2+或S2- )没有产生明显的CL发射(图2E),表明MnOx和基于PFODBT的SPN之间的反应具有高特异性。从690-770和820-880 nm通道观察到强发光,表明NIR发射波长(图2F和2G),这与PFODBT的FL发射一致(图3D)。此外,MnOx-SPNs系统表现出超灵敏的pH依赖性CL和FL发射(图2H)。随着pH值的降低,CL强度逐渐增强,同时FL排放量持续降低(图2H和2I)。此外,MnOx-SPNs的CL半衰期长达半小时(图2J和2K)。

图2.用于pH响应CL成像的MnOx-SPNs系统
机理研究
图3做了对照证明Mn对SPN的催化影响。(1)引发酸性时,从MnOx纳米片中释放MnIII离子以生成1O2。(2)在MnIII离子的催化作用下,1O2通过π2-π2环加成反应氧化了聚合物单元中的噻吩,形成了噻吩-二氧杂环丁烷中间体。(3)该中间体不稳定并自发降解并产生化学能。(4)化学能通过化学电子交换发光(CIEEL)过程从噻吩-二氧杂环丁烷中间体转移到未氧化的半导体聚合物中。(5)激发的半导体聚合物同时产生持久的发光和大量的1O2。
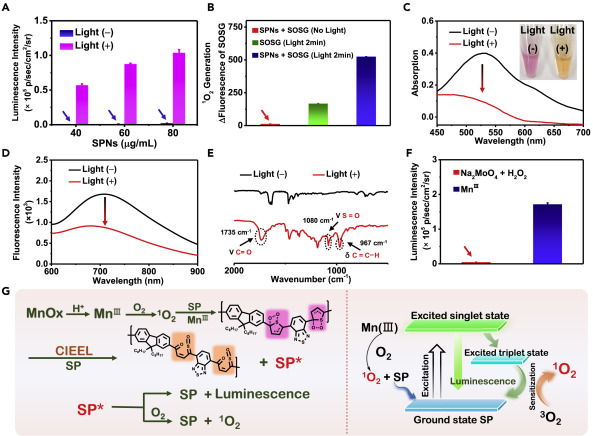
图3. MnOx-SPNs(PFODBT)系统的CL的机理研究
CL/FL排放与1O2产生之间的关系
作者用不同浓度的MnOx(0-100μg/mL)孵育了SPN,然后在活体动物成像系统中捕获了它们的CL和FL图像(图4F)。正如预期的那样,随着MnOx浓度的增加,CL强度逐渐增加(图4G),而FL强度连续下降(图4H)。由于CL和FL的规则逆变化,CL/FL的强度比可进一步用于比率成像。有趣的是,CL/IFL的比例与MnOx浓度呈正相关(图4I)。此外,更多的MnOx参与也导致更高的1O2水平(图4J)。作者尝试使用比率信号(CL/FL强度)来监视1O2的产生。在按照ICL/IFL的比例绘制1O2的产量后(图4K),

图4.用于增强的1O2生成的MnOx-SPNs(PFODBT)和与1O2相关的比例CL/FL
体外成像及化学动力学治疗
在4T1细胞共聚焦图像中,作者发现用MnOx-SPNs处理的那些细胞显示出比单独用MnOx和SPNs处理的那些细胞更强的SOSG荧光,这表明SPN仍可以促进癌细胞内MnOx产生1O2的能力。(图5A)接下来,作者通过测量分别与SPN,MnOx或MnOx-SPNs孵育的4T1细胞和HeLa细胞的细胞生存力来测试其对癌细胞的抗癌活性(图5B和5C)。作者发现,MnOx对癌细胞具有明显的抑制作用,而仅用SPNs处理的细胞则未观察到细胞毒性。值得注意的是,MnOx-SPNs对4T1细胞和HeLa细胞的抗癌活性均高于单独的MnOx,这与由MnOx-SPNs引起的细胞ROS产生更多有关。

图5.与体外抗癌作用相关的细胞ROS产生和CL/FL成像
MRI核磁成像
考虑到MnOx的MRI性能及其依赖于pH的降解特性,作者还研究了SPN激活的MnOx的MRI信号放大(横向弛豫,1/T2)(图6A)。此外,随着pH值降低,MnOx-SPNs的1/T2逐渐升高(图6E)。接下来,向瘤内注射4T1荷瘤小鼠的MnOx-SPNs(0.5mg/mL),并使用T2-MRI序列在不同的时间点进行扫描。随时间推移,注射MnOx-SPNs的肿瘤区域逐渐变暗,表明MnOx-SPNs可以作为体内T2-MRI的pH响应对比剂(图6F)。

图6.用于可激活MRI的MnOx-SPN
体内癌症治疗的可激活CL和比率CL/FL成像
由于在体外的优异CL性能,研究了该系统是否可用于体内CL成像。使用IVIS光谱成像系统(采集120 s)收集CL图像(图7A),并量化肿瘤的CL强度(图7A)。重要的是,与仅用MnOx治疗的肿瘤相比,MnOx-SPNs表现出更显着的肿瘤生长抑制作用(图7C和7D)。为了进一步验证体内肿瘤损伤,在免疫荧光末端脱氧核苷酸转移酶介导的dUTP-生物素缺口末端标记(TUNEL)染色和苏木精和曙红(H&E)染色处理后24小时将肿瘤切片(图7E和7F)。作者发现在PBS和SPNs注射的肿瘤中没有出现明显的凋亡信号和病理变化。

图7.用于可激活CL成像和体内动态疗法的MnOx-SPN
接下来,作者研究了比例成像在体内与治疗效果相关的潜力。可以预期的是,随着MnOx浓度的增加,这些肿瘤的CL图像会随着FL图像的减弱而逐渐变亮(图8A和8C)。从CL/FL图像计算,肿瘤区域的ICL/IFL比率也与MnOx浓度呈正相关(图8D)。

图8.比例CL/FL成像与体内抗癌作用相关
参考文献:doi.org/10.1016/j.chempr.2020.06.024
版权声明:「高分子材料科学」是由专业博士(后)创办的公众号,旨在分享学习交流高分子材料科学等领域的研究进展。上述仅代表作者个人观点。如有侵权或引文不当请联系作者修正。商业转载或投稿请后台联系编辑。感谢各位关注!



















评论