荣昌生物科学领路人房健民|江湖
 以中药起家的荣昌制药,在2008年创立了生物制药公司荣昌生物,那时候的本土创新仍然一派冷清。
以中药起家的荣昌制药,在2008年创立了生物制药公司荣昌生物,那时候的本土创新仍然一派冷清。
经过十几年的发展,荣昌生物在2021年进入收获期:3月,治疗系统性红斑狼疮的泰它西普获批;6月,ADC(抗体药物偶联)维迪西妥单抗获国家药监局批准,成为中国本土首款上市的ADC。
“即便在中国生物医药还没有创新土壤、药监改革尚未开始的最困难的情况下,国内最热的PD-1抗体研发大潮中,我们对ADC的研发投入和开发也没有放弃过,并始终坚信其临床价值和未来前景。”荣昌生物创始人、CEO房健民博士告诉研发客。房健民与荣昌生物及ADC药物有何不解之缘?
“择荣昌而栖”
房健民博士是恢复高考后的第二批大学生。上世纪90年代初,他前往加拿大攻读博士学位,随后到美国,在“血管新生治疗理论之父”、哈佛大学医学院福克曼教授(Moses Judah Folkman)实验室接受博士后训练。
2008年,在国外学习、工作和创业近20年的房健民博士决定回国。通过熟人,他遇到了荣昌制药创始人、董事长王威东,逐渐了解荣昌制药的发展历程和理念,觉得自己的梦想也许可以从这里开始。
 房健明博士
房健明博士
荣昌制药成立于1993年,最早在中国传统医药理论指导下研制而成的治痔新药——荣昌肛泰曾在坊间口口相传。不过,王威东不满足这一OTC产品,于是,不断谋求从中药和仿制药开发中转型。
1999年,荣昌制药与另一个留美学者团队合作成立烟台麦得津生物公司,研究开发抗癌基因药物。功夫不负有心人,他们开发出一类生物药“恩度”,该药于2005年在中国获准上市。但由于种种原因,恩度上市不久,该药及麦得津生物公司一并转让给了南京先声制药,荣昌制药的第一个生物制药梦并没有延续。
本世纪初,伴随生命科学基础研究和生物技术的持续发展,抗体的筛选壁垒开始下降,抗体药开发关键的抗体工程、表达系统、生产工艺、分析方法等技术也取得了巨大进步,这令抗体药研发得到快速发展。
虽然当时中美之间在生物制药领域存在巨大差距,但房健民预见中国即将进入抗体药研发快速发展时代,他设想开发first-in-class或best-in-class抗体药的计划令荣昌制药几个创始人非常感兴趣,“做自己的创新药”的想法使他们一拍即合。于是,2008年荣昌制药与房健民合资成立了荣昌生物公司。
谈到为何选择ADC,房健民有几方面的考虑。首先,ADC药物在全球和中国有巨大的临床需求,据平安证券分析,2020年全球ADC药已达25.1亿美元,预计2025年可达210.7亿美元,复合增长率超过50%。根据戊戌数据统计,虽然ADC药物我国仅有38项正在开展的临床试验,但预计我国ADC市场2020年已达32.6亿元人民币,处于快速增长期。第二,荣昌生物在转型中需要以ADC药物、双抗药物为切入点,并为未来进入FIC做准备。第三,房健民的研究方向是抗肿瘤和自身免疫疾病的生物药开发,尤其是单克隆抗体和蛋白质工程新药研究,ADC与他熟悉的领域相关。
经过再三斟酌,房健民团队决定以开发出优于罗氏当时在研的ADC药物恩美曲妥珠单抗(又称T-DM1)的best-in- class新药为目标,设计并试验了一组含有不同的连接子和毒素的ADC分子,并在细胞和动物实验评估了不同的ADC,最终根据研究结果选择最优的分子进入临床,作为自主创新的“第一枪”。
优化的ADC药物设计
恩美曲妥珠单抗是由靶向HER2的曲妥珠单抗与微管抑制剂DM1(一种美登素衍生物)通过MCC linker连接而成的ADC药物,主要作为单一制剂用于治疗既往已接受赫赛汀和紫杉烷化疗(单独或联合治疗)的HER2阳性转移性乳腺癌患者。该药于2019年在中国上市。
房健民设计的维迪西妥单抗,其结构包括新型人源化HER2抗体(disitamab)和作为毒素载荷的种高效微管蛋白结合剂一甲基澳瑞他汀E (MMAE)。两者之间通过一个可被酶剪切的连接子相连接。这一新药分子被世界卫生组织名命名为Disitamab Vedotin,被中国国家药典委员会命名为维迪西妥单抗。
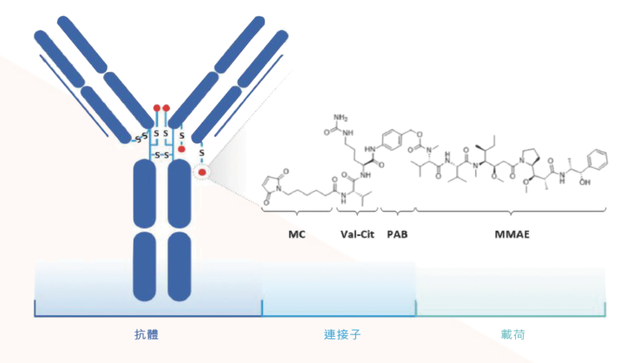 维迪西单抗的结构。MC为maleimidocaproyl的缩写,MMAE为一甲基澳瑞他汀E的缩写,PAB为p-aminobenzyl的缩写,MC-Val-Cit-PAB为蛋白酶可剪切的ADC连接子。来源|荣昌生物官网
维迪西单抗的结构。MC为maleimidocaproyl的缩写,MMAE为一甲基澳瑞他汀E的缩写,PAB为p-aminobenzyl的缩写,MC-Val-Cit-PAB为蛋白酶可剪切的ADC连接子。来源|荣昌生物官网
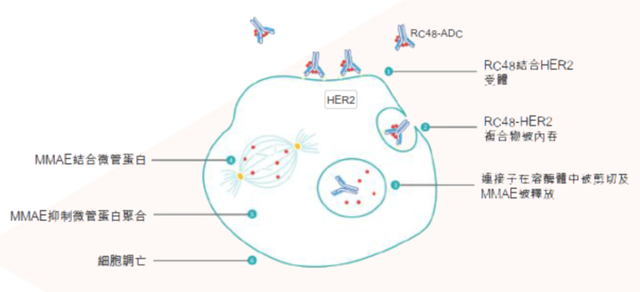 维迪西单抗的作用机制 来源|荣昌生物官网
维迪西单抗的作用机制 来源|荣昌生物官网
具有快速内吞的新型HER2抗体、具旁杀效应(bystander effect)的载荷,以及能在溶酶体中能快速释放载荷的连接子,这些特征使维迪西妥单抗具有强大的抗肿瘤活性和良好的安全性。“维迪西妥单抗的分子结构决定了其在临床上良好的抗肿瘤潜力。”房健民说,“好的设计就等于成功了一半。”
十年前,我国在ADC药物技术上还是一片空白,房健民团队于2014年向国家药监局递交了该药的临床试验申请,2015年获得临床试验批件。
HER2低表达癌症试验设计
在适应症选择上,荣昌生物并没有选择传统HER2药物靶向的乳腺癌,而是选择了国内临床急需、容易复发以及缺少药物的肿瘤适应症。
长期以来,我国消化系统领域非常缺少新的治疗药物。从最早的临床试验开始,北京大学肿瘤医院副院长、消化肿瘤内科主任沈琳教授对维迪西妥单抗很感兴趣,并投入了极大热情,先后主持了维迪西妥单抗在胃癌的多个临床试验。
根据该药的特点,在入组病人时,沈琳教授推翻了原有HER2靶向药物只针对HER2高表达肿瘤病人的常规,允许HER2低表达(IHC 2+/FISH-)的病人入组,且开创性地建议患者不需要做HER2基因扩增(FISH)检测。这一做法不仅拓宽了入组患者的范围,还简化了病人治疗前的病理检查。
“这项研究的亮点在于在入组人群筛选上进行了大胆的设计,重新定义了HER2靶向治疗,扩展了抗HER2治疗应用人群的范围,证明了HER2高表达患者和低表达患者都可以通过维迪西妥单抗治疗得到临床获益。”房健民说。
自2018年启动关键性临床研究,用单臂试验开展临床试验,2020年递交胃癌适应症上市申请,2021年6月获批上市,荣昌生物创造了新药研发的中国速度。维迪西妥单抗的最终批准主要是基于一项单臂、开放、多中心Ⅱ期临床试验,即C008研究,共127例既往接受过2线治疗的 HER2过表达晚期胃癌(包括胃食管结合部腺癌)患者入组。
结果显示,患者经过该药治疗以后ORR为24.4%,DCR为41.7%,中位PFS达4.1个月,中位OS为7.6个月,在无药可用的三线胃癌病人获得了较好的疗效,满足了临床的迫切需求。
非常有意义的是,在胃癌这个适应症,几年前罗氏的T-DM1的临床试验失败了,而荣昌生物的维迪西妥单抗凭借差异化取得了成功。
在转移性尿路上皮癌,维迪西妥单抗更展示了其优越的疗效。由北京大学肿瘤医院副院长郭军教授牵头的维迪西妥单抗在治疗尿路上皮癌适应症的临床试验获得了突破性成果,不仅在全球首开靶向HER2治疗尿路上皮癌之先河,而且在该肿瘤上获得了中美两国药监局突破性疗法双重认定,这在我国ADC药物领域尚属首次。
目前,荣昌生物已向国家药监局递交了该药治疗尿路上皮癌的上巿申请,有望明年上半年获批,成为全球第一个以HER2为靶向治疗尿路上皮癌的first-in-class的药物。同时,该药针对尿路上皮癌在美国的Ⅱ期临床试验正在开展,预计在美国将以尿路上皮癌作为首发适应症上市。
除此之外,维迪西妥单抗在乳腺癌的两个Ⅲ期临床试验也正在开展。11月11日,荣昌生物在药物临床试验登记与信息公示平台登记了一项维迪西妥单抗治疗HER2阳性黑色素瘤的Ⅱa期临床。
迄今为止,该药开展的临床研究覆盖了胃癌、乳腺癌、非小细胞肺癌、胆道癌、妇科肿瘤等(如下,点击可见大图)。
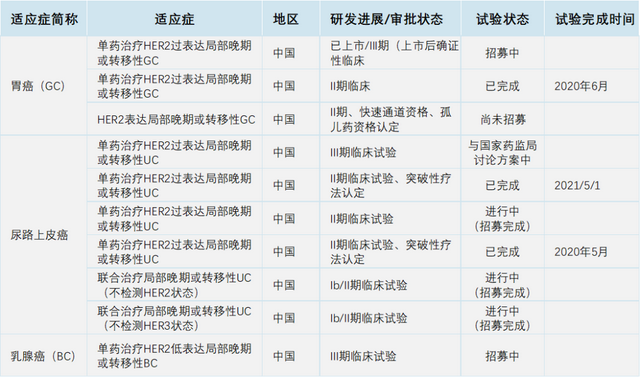
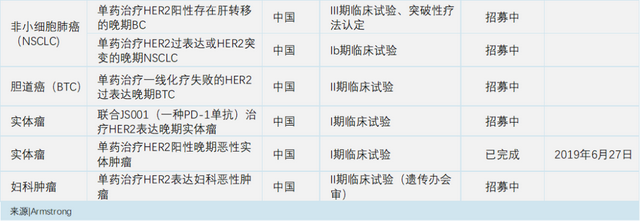
全面转型迈向国际公司
获批后不久,维迪西妥单抗就达成了一项26亿美元的独家全球许可协议:荣昌生物将维迪西妥单抗在亚洲区(除日本、新加坡外)以外的临床开发和商业化权益,授权给美国ADC公司西雅图基因(Seagen Inc.)。
据统计,去年我国企业对外许转让项目为66项,交易金额达72.15亿美元,维迪西妥单抗26亿美元的交易额创下了我国单药license-out 新纪录。
“中国企业只要踏实做出原创产品,临床研究数据和质量过硬,就有底气以高价格转让。”房健民说。
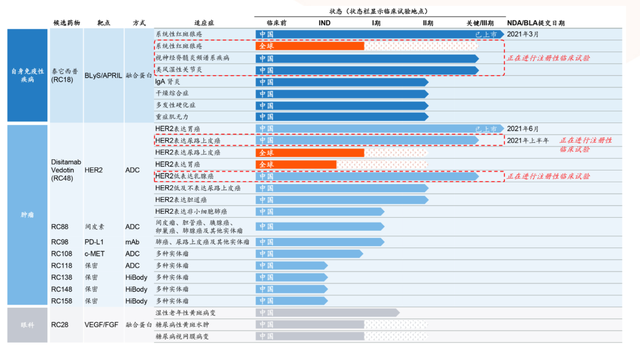 荣昌生物在研产品线 来源|荣昌生物官网
荣昌生物在研产品线 来源|荣昌生物官网
告别了过去研发投入有限的日子,荣昌生物的研发费用正大幅增长:2021年1~9月同比增长约65%。11月11日,荣昌生物科创板IPO已经过会,计划募集资金总计约40亿元。
眼下,荣昌生物已具备商业化生产单克隆抗体、融合蛋白、ADC、双抗等复杂药物化合物的一体化生产能力,厂房硬件配套设施已达到国际标准。随着ADC药物上市、自建销售团队,并力争将已上市产品加入医保目录。
荣昌生物正在实现三个转型:从研发公司到商业化阶段转型,从小型生物技术公司到大型生物制药公司转型,从本土企业到国际化公司转型。未来,荣昌生物将继续坚持创新,在自身免疫性疾病、肿瘤和眼科领域发展。“我的工作动力来源于看到我们的项目一步步取得不断进展,新药在临床试验和医疗实践中令患者获益。”房健民说。
编辑|姚嘉 版式|张跃
总第1489期



















评论