新加坡医疗器械那些事
基础科普
医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件。
效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用。
目的是疾病的诊断、预防、监护、治疗或者缓解;损伤的诊断、监护、治疗、缓解或者功能补偿;生理结构或者生理过程的检验、替代、调节或者支持;生命的支持或者维持;妊娠控制;通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
注 册
一.概览 1.评估路径(每个设备都通过特定的评估路径完成注册,具体路径取决于:)
(1)医疗设备的风险等级(A类医疗器械免予产品注册)
(2)医疗设备在营销期内无安全隐患的持续时长
(3)已获管理机构事批准的设备数量
2.优先审查计划-更快完成注册、进入市场

二.定性
1.(完成问卷)—设备是医疗器械吗
(1)产品是否服务于人类?
(2)产品是否能通过体外诊断(如:妊娠检测试剂盒)提供医疗诊断信息?
2.问卷结果
(1)产品是医疗器械,确认风险等级
(2)产品不是医疗器械,受新加坡其他相关机构监管
三.确认医疗器械的风险等级(可通过问卷确定等级)
1.通用医疗器械 风险等级 风险程度 举例
A 低风险 轮椅或压舌板
B 低至中度风险 皮下注射针头或抽吸设备
C 中度风险至高风险 呼吸机
D 高风险 植入式除颤器
2.体外诊断医疗器械 风险等级 风险程度 举例
A 低个人风险和低公共卫生风险 样本容器
B 中度个人风险或低公共卫生风险,或两者兼具 妊娠自检,尿检试纸
C 高度个人风险或中度公共卫生风险,或两者兼具 血糖自检,白血球抗原分型
D 高度个人风险和高度公共卫生风险 HIV病毒诊断试剂盒 四.注册及发牌
1.根据自身情况(如进口商、制造商、供应商)以及设备的使用目的等,通过问卷,查阅注册及发牌条件;
2.确定医疗器械的评估路线。B类、C类、D类医疗器械的评估路线均可分为全面评估、简化评估、加速注册、即时注册。各评估路线适用条件各有不同,以B类医疗器械不同评估路线适用的条件为例: 评估路线分类 全面 简化 加速B类注册(EBR) 即时B类注册(IBR) 适用条件 产品尚未获得HSA任何参考监管机构的批准 产品至少获得1个HSA参考监管机构的批准 细分为EBR-1和EBR-2两种评估路径。 其中EBR-1适用于:
•产品至少获得1个HSA独立参考监管机构的批准;
•在上述独立参考监管机构的管辖下,上市时间≥3年;
•无全球安全问题 EBR–2适用条件:
•产品至少获得2个HSA独立参考监管机构的批准;
•产品至少获得2个HSA独立参考监管机构的批准;
•在上述2个独立参考监管机构的管辖下,上市时间≥3年;
•无全球安全问题
•之前未被任何独立参考监管机构或HSA拒绝/召回。
3.明确完成注册所需的文件、注册费用和注册时间;同样以B类医疗器械不同评估路线适用的条件为例:
文件要求 全面 简化 加速B类注册(EBR-1 and EBR-2) 即时B类注册(IBR)
1 授权书 √ √ √ √
2 配置列表 √ √ √ √
3 参考机构的批准证明 √ √ √
4 在参考监管机构管辖下的销售历史证明,例如注有日期的发票,销售证明或营销历史声明 √ 仅在EBR-1评估时需要 √
5 无全球安全问题的声明 √
6 经营综合报告 √ √ √ √
7 基本原则清单和符合性声明 √ √ √
8 设备介绍 √ √ √ √
9 设计验证和验证文件,包括:
•临床前研究,例如物理测试数据,生物相容性研究,动物研究和软件验证和验证研究
•计量要求 •灭菌验证(如适用)
•保质期研究和预计使用寿命 √ 详细报告 √ 概要 √ 概要 √ 仅无菌设备需要灭菌验证文件 10 临床证据 如适用 11 拟用的设备标签 √ √ √ √ 12 风险分析 √ 如适用 13 制造商信息(工厂名称和地址) √ √ √ √ 14 质量管理体系(QMS)证明 - ISO 13485质量管理体系认证证书,符合美国FDA质量体系规定或日本MHLW条例169的认证声明。
15 制造流程-流程图 风险等级
注册所需时间(工作日)
全面 简化 加速B类注册(EBR-1 and EBR-2) 即时B类注(IBR) B类医疗器械 1 6 0 1 0 0 60 提交后立即注册 风险等级 申请费用 (单位:新元,S$)
评估费用(单位:新元,S$)
全面 简化 加速B类注册(EBR-1 and EBR-2)
即时B类注册(IBR) B类医疗器械 500 3,500 1,800 900 900 五.优先审查计划-更快完成注册、进入市场
1.适用对象:进行全面评估的B类、C类、D类医疗器械
2.优先审查路线
(1)路线1—适用于五个重点医疗领域:癌症、糖尿病、眼科疾病、心血管疾病、传染病;为未满足的临床需要而设计的医疗器械;
(2)路线2:不符合路线1两条准则的其他医疗器械。
六.特殊通道(SAR):特定情况下,HSA可通过特殊通道批准进口和供应未注册的医疗器械。
对 比 中 国 中国与新加坡在医疗器械的分类方面存在不同,与新加坡分为四类不同,中国分为三类“第一类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械。第二类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械。第三类是具有较高风险,需要采取特别措施严格控制管理以保证其安全、有效的医疗器械”(《医疗器械监督管理条例》)。医疗器械的分类规则和分类目录由国务院食品药品监督管理部门负责制定,并根据医疗器械生产、经营、使用情况,及时对医疗器械的风险变化进行分析、评价,对分类目录进行调整。
中国的法律规定中不存在“仿制医疗器械”的说法。
第一类医疗器械实行备案管理,第二类、第三类医疗器械产品实行注册管理;第一类医疗器械不需要进行临床评价;第二类医疗器械产品原则上不需要进行临床评价;第三类医疗器械产品注册,应当进行临床评价,其中,用于支持或者维持生命或者临床使用具有高风险的第三类医疗器械,原则上需要开展临床试验。
境外创新企业(未在境内外上市的企业)可不递交境外上市证明材料。
《医疗器械监督管理条例》第九条: 第一类医疗器械产品备案和申请第二类、第三类医疗器械产品注册,应当提交下列资料:
(一)产品风险分析资料
(二)产品技术要求
(三)产品检验报告
(四)产品说明书及标签样稿
(五)与产品研制、生产有关的质量管理体系文件
(六)证明产品安全、有效所需的其他资料 产品检验报告可以是医疗器械注册申请人或者备案人的自检报告或者委托有资质的医疗器械检验机构出具的检验报告
申请第二类、第三类医疗器械产品注册,需要临床评价的,还应当按照规定提交医疗器械临床评价资料
医疗器械注册申请人、备案人应当确保提交资料的真实、完整和可追溯 医疗器械注册证有效期为5年;附条件批准注册的,由国务院药品监督管理部门在医疗器械注册证中明确有效期。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。”
第十一条:申请第二类和第三类医疗器械产品注册,注册申请人应当向国务院药品监督管理部门提交注册申请资料。
向我国境内出口第二类、第三类医疗器械的境外注册申请人,应当由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院药品监督管理部门提交注册申请资料和注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。未在境内外上市的创新医疗器械,可不提交注册申请人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。
第十七条 第一类医疗器械产品备案,不需要进行临床试验。申请第二类、第三类医疗器械产品注册,应当进行临床试验;但是,有下列情形之一的,可以免于进行临床试验:
(一)工作机理明确、设计定型,生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的;
(二)通过非临床评价能够证明该医疗器械安全、有效的;
(三)通过对同品种医疗器械临床试验或者临床使用获得的数据进行分析评价,能够证明该医疗器械安全、有效的。免于进行临床试验的医疗器械目录由国务院食品药品监督管理部门制定、调整并公布。
第十九条 第三类医疗器械进行临床试验对人体具有较高风险的,应当经国务院食品药品监督管理部门批准。临床试验对人体具有较高风险的第三类医疗器械目录由国务院食品药品监督管理部门制定、调整并公布。
国务院食品药品监督管理部门审批临床试验,应当对拟承担医疗器械临床试验的机构的设备、专业人员等条件,该医疗器械的风险程度,临床试验实施方案,临床受益与风险对比分析报告等进行综合分析。准予开展临床试验的,应当通报临床试验提出者以及临床试验机构所在地省、自治区、直辖市人民政府食品药品监督管理部门和卫生计生主管部门。
监 管
1.在新加坡,对药物,生物制品和医疗器械享有管辖权的监管机构。
新加坡卫生科学局(HSA)。它是根据《卫生科学授权法》于2001年4月1日成立的卫生部法定委员会。
2.监管范围
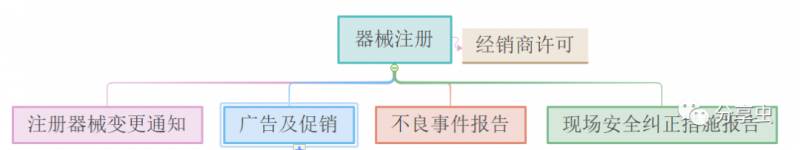
·必须先注册才能供应该设备,注册要求将根据设备的风险分类和评估途径而有所不同。
·所有医疗设备经销商都必须先申请经销商许可,才能在新加坡进口,制造和供应设备。HSA会先评估是否符合《良好销售规范》的要求,再授予许可。
·更改医疗设备必须事先通知HSA。包括技术更改、审查更改、管理更改、通知更改以及“现场安全纠正措施”造成的更改。
·如果设备对用户健康构成风险,则必须通知HSA,采取补救措施,并告知用户、医疗人员以及公众。
小 疑 问 1.患者的药物和设备如何支付?
第一层:新加坡的国家医疗体系融资来源
Ø 政府直接补贴:最高可覆蓋公立医院急症住院费的80%
Ø 强制性个人医疗储蓄账户计划Medisave,出自员工工资和雇主(类比国内的五险一金?)
Ø 基础低成本医疗保险计划MediShield Life,主要针对高额的医疗账单和门诊费用,如透析化疗等
Ø 政府资助医疗基金MediFund
Ø 其他:社区卫生援助计划、老年人临时残疾援助计划(此两项主要针对残疾人和老年人)药物援助基金(公共部门医疗机构为某些药物提供补贴)
第二层:私营部门(私人保险公司等):根据保单为药品和医疗器械产生的费用提供补偿 两者在不同领域所占比例: 初级保健部门:私营部门约占市场的80%。
急诊部门:公共部门提约占80%。
降级保健部门:自愿性福利组织占大多数市场,大部分由政府资助提供服务。
2.谁来分配药物和设备?获得什么补偿(报销)?
药物分为: POMs处方药——由医生或者牙医提供,或者在药店凭医生或牙医开具的处方购买 P-medicines纯药房药品——不需要处方,在药店药剂师的指导下购买 GSL通用销售清单药品——任何零售商处均可购买
医疗设备: 仅用于专业用途——医疗设备许可批发商/有资格证的医生或牙医 仅供受过培训的用户——受到过制造商认为有必要的关于安全有效使用该设备的培训的人员 政府为某些药物提供补贴(见第一条内容)




















评论