「行研」抗体药物偶联物ADC(二)——研发进展梳理
关注【行研】抗体药物偶联物ADC(二)——研发进展梳理,获取最新行业资讯
2021年8月9日,荣昌生物与Seagen就开发和商业化其HER2-ADC新药RC48(维迪西妥单抗)达成一项全球独家许可协议,荣昌生物将保留RC48在亚洲(除日本、新加坡外)进行临床开发和商业化的权利,Seagen则获得RC48全球其他地区开发和商业化权益。
RC-48是首个License out的国产ADC新药,此次交易创下了中国创新药单药出海交易金额的新纪录,是本土创新药药企研发实力增强的重要标志,也预示着ADC赛道具有爆发的潜力。
前文【行研】抗体药物偶联物(ADC)行业研究(一)梳理了ADC药物结构、作用机理、技术迭代、市场规模等,本文继续梳理其研发进展。
ADC--已上市药物
全球目前已有14款上市的ADC药物,治疗领域主要集中在血液瘤和实体瘤方面,主要用于患者的后线治疗,包括晚期、复发/难治性以及转移性的肿瘤适应症。从疗效数据来看,ADC药物给后线患者带了更多的治疗选择和延长生存期的希望,有多款药物的ORR或mPFS相比化疗提高了一倍。
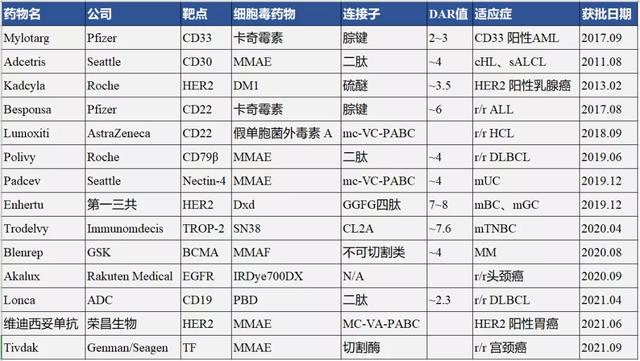
图片来源:公开资料整理
简单介绍其中几款典型的ADC:
1、Gemtuzumab Ozogamicin (Mylotarg)
Mylotarg是全球第一个上市的ADC,靶点为 CD33。Mylotarg由高活性的DNA裂解剂卡奇霉素偶联到Gemtuzumab单克隆抗体(突变的抗CD33 IgG4抗体)上形成,连接子为含有腙键的可断裂连接子。
Mylotarg是一种含有约50%的未偶联单克隆抗体的复杂混合物,平均DAR为1.5,被细胞内化后,可以在内涵体酸性环境中水解,释放出卡奇霉素的前体,然后被谷胱甘肽还原为游离的活性卡奇霉素,后者与DNA小沟结合,并经过Bergman环化作用,从而产生高反应性双自由基,引起序列选择性的DNA双链断裂。
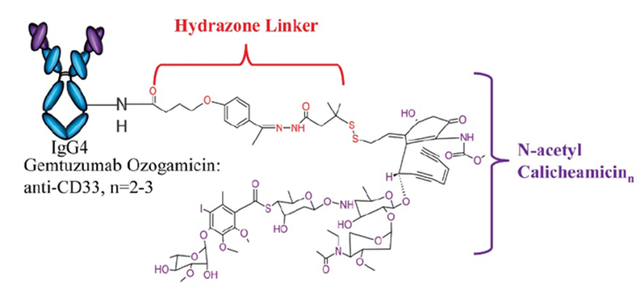
Mylotarg结构,图片来源:生物制药小编
2、Trastuzumab Emtansine (Kadcyla)
Kadcyla于 2013 年被 FDA 和 EMA 批准用于治疗 HER2+ 转移性乳腺癌。该款ADC是DM1通过不可切割的硫醚连接子 4-(N-马来酰亚胺甲基)环己烷-1-羧酸酯 (MCC) 连接到曲妥珠单抗的赖氨酸残基上。
由于使用了不可裂解的Linker,因此弹头的释放需要溶酶体内的蛋白水解酶逐步地把抗体部分水解至单个的氨基酸,即形成带有赖氨酸的Lys-MCC-DM1,随后Lys-MCC-DM1整体结合到微管蛋白上,抑制微管的正常组装,从而使细胞分裂停滞,最后造成细胞凋亡,由于Lys-MCC-DM1中的Lys部分在细胞内环境中带电,不能自由地穿过细胞膜,因此不具有旁观者效应。
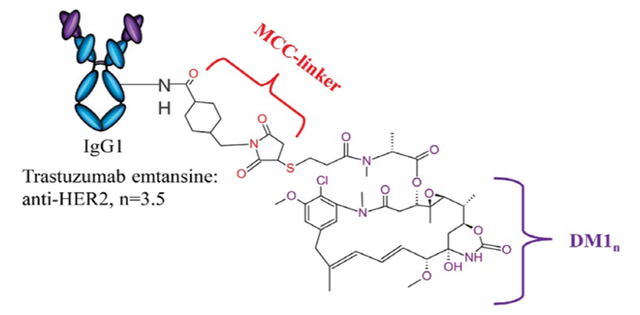
Kadcyla结构,图片来源:生物制药小编
3、DS-8201a (Enhertu)
2019年12月,DS-8201a被FDA加速批准用于治疗既往已经接受过2种以上HER2靶向疗法的不可手术切除或转移性HER2阳性乳腺癌成人患者。Enhertu由第一三共独有的DXd技术平台设计开发,阿斯利康于2019年3月以69亿美元的免疫肿瘤学合作加入,共同开发Enhertu。
Enhertu由拓扑异构酶 I 抑制剂有效载荷 (DXd) 通过可切割的四肽连接子组成,连接子与抗体上的半胱氨酸残基相连,该款ADC药物的 DAR 约为8。
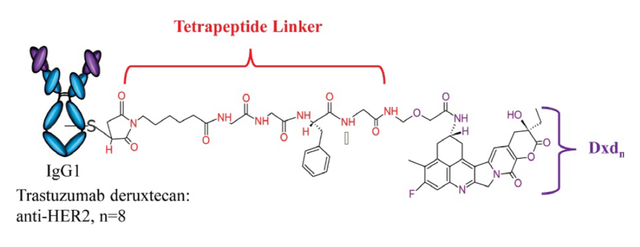
Enhertu结构,图片来源:生物制药小编
4、Belantamab Mafodotin(Blenrep)
Belantamab mafodotin于 2020 年获得 FDA 和 EMA 批准用于复发或难治性多发性骨髓瘤。该款ADC药物由无岩藻糖基化单克隆抗体组成,抗体通过连接到半胱氨酸残基的抗蛋白酶马来酰亚胺己酰基 (MC) 连接子与微管破坏剂单甲基 auristatin-F(MMAF) 偶联。
该款ADC抗体靶向BCMA,其 Fc 区被无岩藻糖基化,增强了抗体介导的细胞毒性,一旦 ADC 与 BCMA 结合,它就会被蛋白酶切割并释放小分子 MMAF,随后MMAF 破坏微管聚合,导致细胞凋亡。
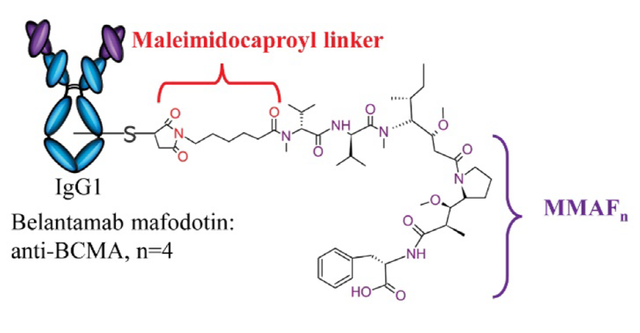
Blenrep结构,图片来源:生物制药小编
5、维迪西妥单抗(RC48)
2021年6月9日,NMPA批准我国首个原创性抗体偶联药物(ADC)新药——维迪西妥单抗(RC48)上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。
该款ADC由靶向HER2的人源化IgG1单克隆抗体、可裂解多肽Mc-VC-PAB连接子和微管抑制剂MMAE组合而成,偶联方式为半胱氨酸随机偶联,平均DAR为4。维迪西妥单抗虽然与Kadcyla均靶向HER2靶点,但具体靶向的HER2受体上的表位存在不同,具有更强的亲和力和内吞性。
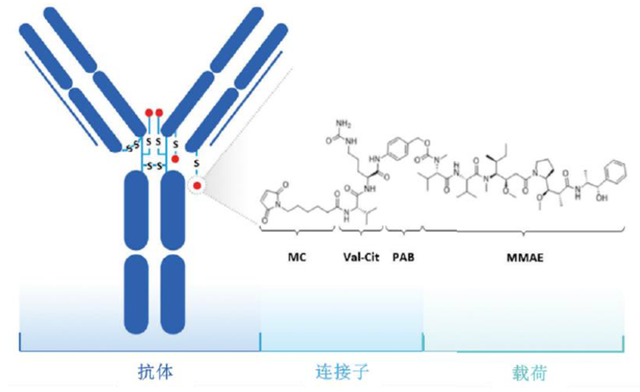
RC18结构,图片来源:生物制药小编
ADC--在研发的靶点
由于ADC治疗效果较好,市场具有较大发展潜力,因此全球范围内研发热度较高。根据药渡不完全统计,目前全球共有156款ADC药物处于临床研发阶段,其中,11款处于临床III期阶段,多数处于临床I期阶段。我国ADC药物研发起步相对较晚,目前共有38款ADC药物,多数仍然处于临床I期和临床前阶段,与国外相比进度较为落后。
从ADC药物的全球发展过程来看,2018年之前HER2是绝对的主流靶点。随着Lumoxiti、Polivy、Padcev、Enhertu等ADC药物的陆续获批,ADC药物研发迎来新一轮热潮,靶点选择也随之快速呈现多样化趋势。
由于国内早期ADC药物研发多以HER2为靶点,目前HER2仍是国内ADC领域布局最多的靶点。此外,Trop2靶向ADC的研发也如火如荼,共有11家企业布局该靶点。除了HER2和Trop2两个热门靶点以外,靶向cMET、EGFR、CD20、CD19的国产ADC药物也陆续进入临床阶段;此外,还有部分公司通过自主研发或合作引进布局了MUC1、ROR1、Claudin18.2、BCMA、Nectin-4等新靶点。
根据安信证券研究,国内ADC药物领域已布局靶点23个,共有67种ADC药物产品在研(其中已有40款ADC药物进入临床试验),形成HER2、Trop2占据主流,新兴靶点百花齐放的局面。
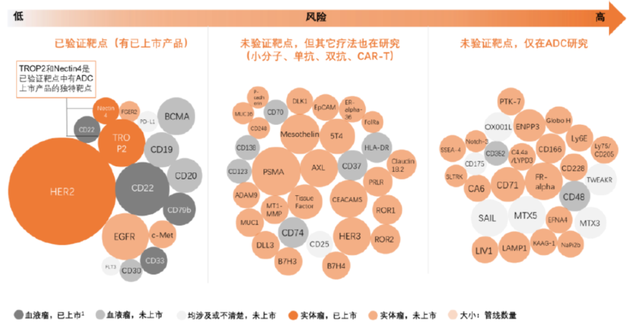
图片来源:平安证券
虽然目前ADC药物部分靶点赛道已经较为拥挤,产品上市就将面临较为残酷的竞争格局,但伴随技术进步,部分ADC研发企业也开始逐步探索创新靶点,该类靶点赛道尚未形成明显竞争格局,仍然有较大的发展潜力,有望出现重磅品种。部分在研的靶点和临床进展如下:
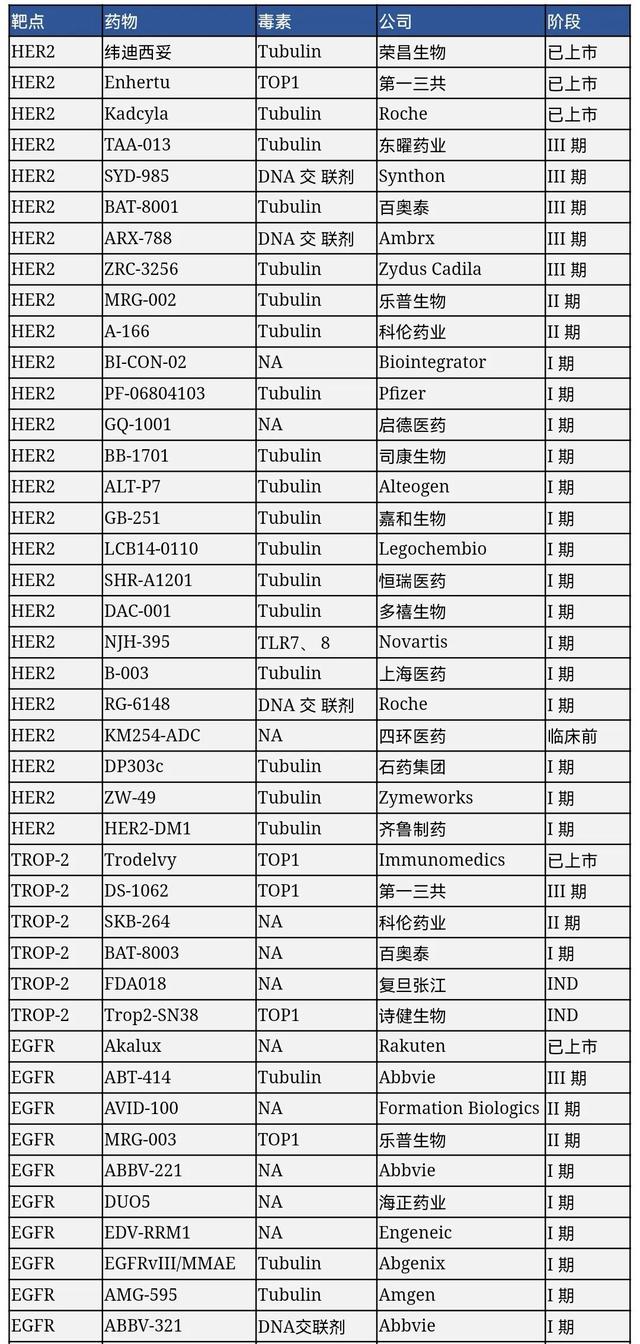
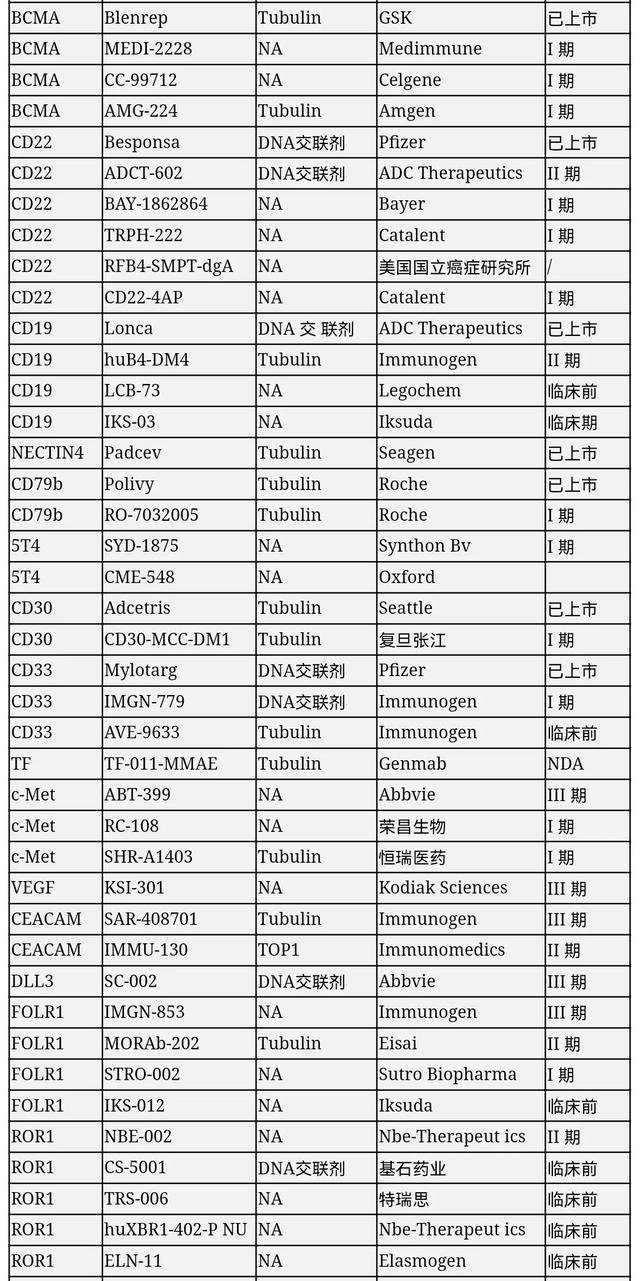
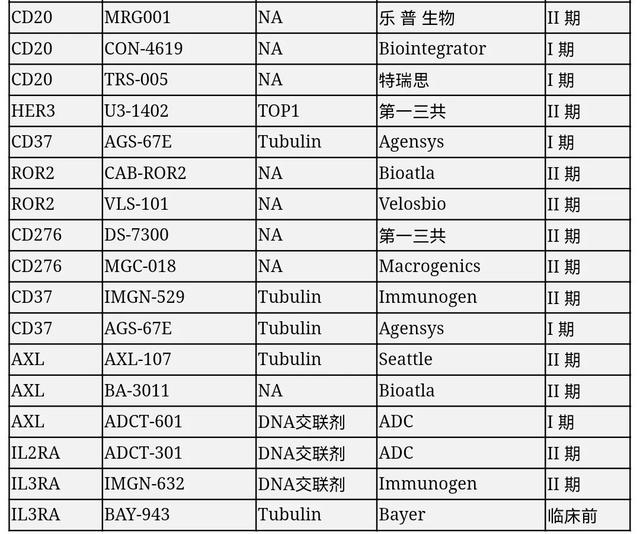
部分ADC在研产品,数据来源:平安证券
ADC--耐药性难题
与所有抗癌疗法一样,耐药性是使用 ADC 的一个关键问题。ADC 耐药机制复杂,受多种因素影响,其耐药性可能来自 ADC 的各个组成部分,也可能来自 ADC 作用机制的通路,如图所示:
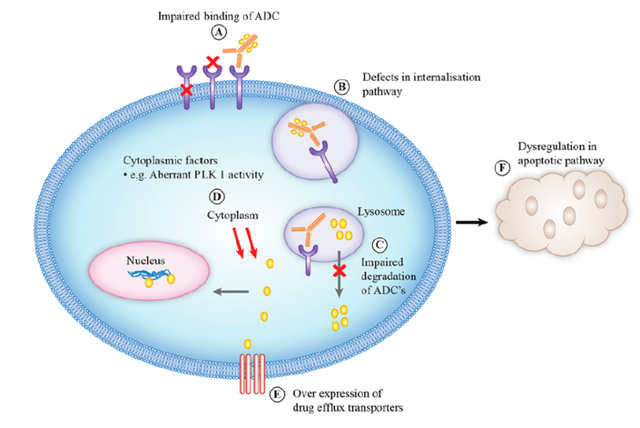
图片来源:PubMed
1、ADC可能耐药机制
ADC 与靶抗原的结合可能会受到抗原下调、抗原表达缺失或抗原突变影响,从而导致ADC的抗体部分识别阻碍。从T-DM1 抗性细胞系中可确定T-DM1耐药的原因是细胞表面HER2的低表达,也有研究表明CD30 抗原表达缺失是导致间变性大细胞淋巴瘤患者对 brentuximabvedotin 产生耐药性的原因。
抗原配体的存在也会导致对 ADC 的抗性。神经调节蛋白是 ErbB3 的配体,它的存在导致 ErbB2 和 ErbB3 异二聚化,从而降低 T-DMI 在乳腺癌细胞系中的细胞毒性。
ADC与靶抗原结合后,ADC-抗原复合物通过网格蛋白或细胞膜内陷介导的内吞作用或胞饮作用被内化,然而这种内化过程可以通过内化途径的缺陷和细胞表面运输蛋白的减少而改变。据研究报道,T-DM1 抗性 N87 细胞将 ADC 内化为细胞内小窝蛋白并改变它们向溶酶体的运输从而导致ADC降解失败。
一旦进入细胞,溶酶体中 ADC 的降解可能会因溶酶体蛋白水解或酸化功能的降低而受损,导致 ADC 的细胞毒性有效载荷无法裂解。对 T-DM1 具有抗性的细胞系研究显示,溶酶体 pH 值升高,导致蛋白水解活性降低,T-DM1 在溶酶体中的积累而无法发挥有效作用。溶酶体转运蛋白如SLC46A3表达的丧失也可以抑制细胞毒性有效载荷从溶酶体释放到细胞质。
有报道称,肿瘤细胞质内的有丝分裂 polo 样激酶 1 (PLK1) 高表达,阻止细胞周期蛋白依赖性激酶 1(CDK1)的激活,CDK1减少将导致无法停止细胞周期进程,从而抑制T-DM1对有丝分裂的影响而产生耐药性。T-DM1 处理可以增加细胞周期蛋白 B1 的表达,导致细胞周期停滞在 G2/M 期,而肿瘤细胞可以通过敲低细胞周期蛋白 B1诱导 T-DM1 抗性。
另外,药物外排转运蛋白可以从细胞中外排ADC,导致耐药,这是化疗耐药的常见机制。肿瘤细胞对有效载荷(细胞毒素)的后天或先天不敏感也可能导耐药,凋亡途径的失调也可能导致癌细胞对 ADC 的敏感性。例如,促凋亡蛋白Bak和Bax缺乏活性或抗凋亡蛋白Bcl-2和Bcl-X过表达导致耐药性等。
2、ADC耐药解决办法
研究人员正在研究各种克服 ADC 耐药性的策略,比如,为了防止细胞外排,将ADC 的有效载荷设计成为不良外排底物的毒素;使用具有替代作用机制的细胞毒性有效载荷也可以克服耐药性,例如,含有蒽环类作为有效载荷的抗 CD22-NMS249ADC 克服了 NHL 模型中对MMAE有效载荷的获得性耐药性。
由于药物流出转运蛋白比亲水性化合物更有效地流出疏水性化合物,因此可以使用基于马来酰亚胺基的亲水性接头设计 ADC,比如使用基于马来酰亚胺基的亲水接头 PEG 4 Mal。
从不可切割连接子切换到蛋白酶可切割的 mc-vc-PAB 连接子成功克服了临床前模型中的 T-DM1 耐药,双特异性和双互补位抗体等新设计也可以增加ADC细胞内化,减少耐药。临床中也正在进行 ADC 与免疫疗法的组合,以克服耐药性并增加临床效果。例如,brentuximabvedotin 和 nivolumab 联合、T-DM1 联合pembrolizumab等临床试验组合。
什么是“好的”ADC
ADC药物的设计有赖于对抗体及其靶点、连接链、细胞毒药物这三种构成要素和偶联方式的慎重选择与合理组合。每一种设计要素都会影响最终药物的安全性和有效性;同时,针对单一设计要素构建的技术研发平台也具有很好的通用性,通过与其它设计要素的组合,可以衍生出丰富的ADC药物结构设计。
1、“好的”抗体技术平台
抗体主要特异性识别肿瘤表面靶抗原,介导ADC药物在肿瘤细胞处的定位和内吞。前文提到抗体应具有高抗原亲和力和较长循环半衰期,以在肿瘤处特异性富集,因此一般选择 IgG 型抗体,综合不同 IgG 亚型的半衰期、结构稳定性、Fc片段免疫功能、偶联便捷性等因素,抗体多选择 IgG1 亚型而很少用IgG4亚型。
为减少抗体自身免疫原性,多选择人源化或全人源化抗体,也有公司对抗体Fc片段进行增强或减弱以调节其介导的免疫反应强度,甚至影响其稳定性和半衰期。为了增加病灶靶细胞的结合特异性和药物在病灶区域的富集能力,双特异抗体也被应用于ADC的设计开发中,以扩大受益人群,为特定单靶标表达水平较低的患者提供治疗选择。Fab抗体、单链可变片段ScFv以及纳米抗体等小型抗体因其较强的实体肿瘤穿透力和较快的肾脏清除率,在改善治疗窗方面也为ADC药物设计提供了选择。中信建投统计的典型的ADC药物抗体技术平台有:
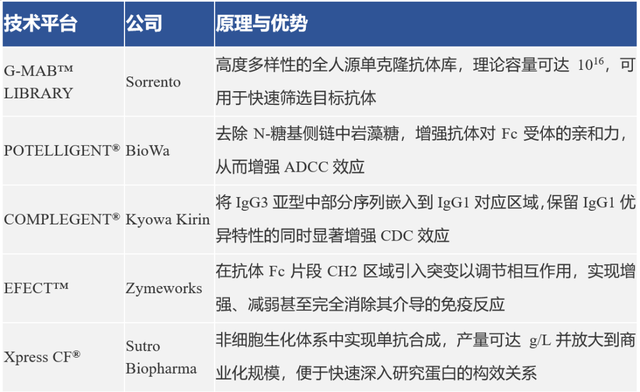
数据来源:中信建投证券
2、“好的”药物载荷技术平台
细胞毒药物主要是释放后结合到相应作用位点,发挥强效肿瘤细胞杀伤作用,需要具有很高的抗肿瘤活性,一般要求单药 IC50 在 0.1nM ~0.001 nM。为了减少因ADC聚集而被加速清除甚至免疫原性增强,同时降低与 MDR1 药物外排泵的相互作用,细胞毒药物需要有一定的亲水性;在与抗体偶联过程中,需要细胞毒药物有适宜的反应位点等。
最常见的药物载荷是微管抑制剂,如甲基澳瑞他汀E(MMAE)、甲基澳瑞他汀F(MMAF)和美登素类(DM1、DM4)。已上市的ADC, 除了Enhertu和Trodelvy选择了干扰DNA复制的拓扑异构酶抑制剂外,其他均选择了微管抑制剂,而且处于临床研究阶段的ADC超过半数选择了微管抑制剂。其他有效载荷,除了前述拓扑异构酶抑制剂外,还包括DNA烷化剂和交联剂、RNA聚合酶抑制剂等,临床及上市药物中接近20%,还有10%左右的ADC其载药机制未公布。
药物载荷的效力也影响DAR值,需要做到最佳配比,比如对于微管抑制剂类的澳瑞他汀类和美登素类,其杀伤细胞的IC50不到1nmol/L,DAR选择通常约为4,较低的DAR可能导致活性丧失,较高的DAR往往导致毒性增加。中信建投总结的常见ADC药物载荷技术平台有:
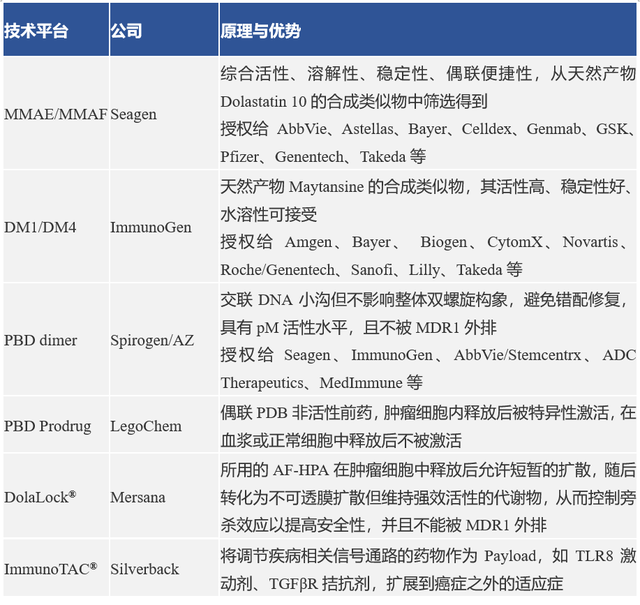
数据来源:中信建投证券
3、“好的”连接子技术平台
连接子的性质直接影响细胞毒药物的药代动力学性质,并且决定药物递送效率和递送到肿瘤处的特异性,对最终疗效和安全性产生影响。ADC药物循环半衰期较长,因此需求连接子在血液循环中应当稳定以防止提前释放药物引发系统性毒性反应,而在肿瘤靶细胞内应高效释放细胞毒药物。
另外,连接子也决定了ADC分子采取的偶联策略。在天然抗体分子结构中,可供选择的偶联策略有2种,即赖氨酸的氨基偶联和半胱氨酸的巯基偶联,偶联策略和偶联位点的选择,对于特定ADC分子的药效和毒性至关重要。而且,通过连接子的优化如采用亲水性的聚乙二醇(PEG)连接子,可以起到平衡有效载荷疏水性作用,从而调节分子的整体性质,增加亲水性、提高水溶性,并实现提高药物分子稳定性和改善药动学特性的目的。
典型的连接子技术平台有Mersana公司的Dolaflexin®,该技术平台利用专有的Fleximer®聚合物偶联到抗体上作为支架,其水溶性好、高度生物相容性、可生物降解,并提供多个载药位点,再通过可裂解的连接子与细胞毒药物偶联,能显著改善药物的溶解度、药代动力学和免疫原性,并且能大幅提高 DAR值。
4、“好的”偶联方式——定点偶联
偶联方式直接决定药物抗体比值(DAR)、偶联位点分布、偶联的稳定性等性质,通常情况下,抗体分子上的天然赖氨酸残基(Lys-NH2)及半胱氨酸残基(Cys-SH)会作为其偶联反应位点;也有通过特殊酶处理或抗体工程化改造在抗体表面添加特殊的活性基团如-C=O、-N3等用于偶联。
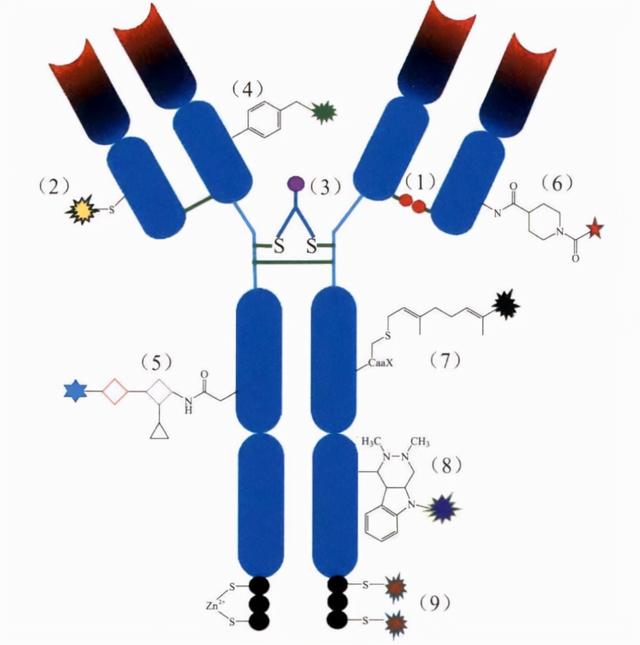
定点偶联,图片来源:CNKI
非定点偶联ADC最终产物是混合物,包括了不一样的DAR和不一样的偶联位点,其稳定性差,易发生聚集,且其中细胞毒素易脱落而产生非治疗性毒副作用,治疗窗较窄;此外,分析鉴定和控制生产批量之间的差异性也是技术上的大难题。为了克服这些难题,定点偶联技术随之出现。定点偶联技术通常需对抗体进行改造或修饰,能在特定位点实现细胞毒素的连接,提高了ADC的均一性,这样不但便于分析鉴定和质量控制,还有利于改善药动学,增加ADC治疗窗口。定点偶联已成为ADC偶联最常用的技术平台,中信建投汇总如下:
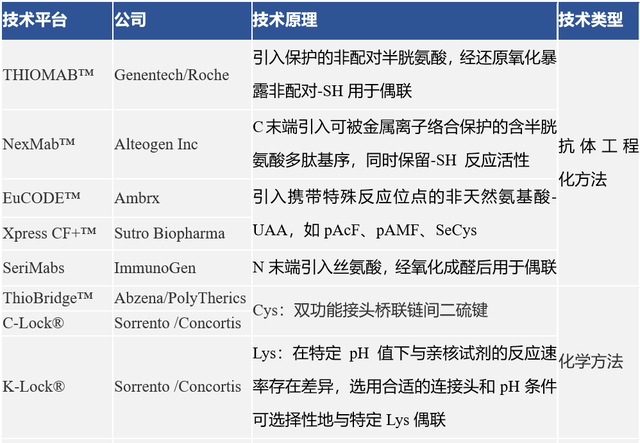

数据来源:中信建投证券
总结
ADC在抗体结构、偶联策略、载药方面具有众多而广泛的选择性。任何一方面的选择和调整都是以获得最佳治疗窗为目的,在此过程中多个专业需要密切配合,需要深入理解ADC分子结构-功能关系,应用生物分析技术对结构和功能进行表征,考察ADC在体内的稳定性、代谢和分布以及分子结构的变化,抗药物抗体(ADA)产生与表征,以及ADA产生对药物安全性和有效性的影响等。
因此无法准确定义什么是“好的”ADC药物,各临床阶段的生物医药研发公司已经深入布局了ADC领域多个专利,包括各种专有技术平台等,随着研发热度增加,ADC的数量及其临床应用将持续增长。下篇我们将继续梳理ADC领域内的公司和其技术平台、产品管线等,敬请期待!
参考资料:
【1】中信建投证券-ADC药物:偶联时代,创新致远
【2】安信证券-创新药研究框架之ADC行业分析:高速发展,迎来初步收获期
【3】平安证券-创新药研发专题系列——ADC:从模仿转型创新之路
【4】Antibody–Drug Conjugates for Cancer Therapy. Molecules. 2020Oct; 25(20): 4764.
【5】基于定点偶联技术的抗体药物偶联物的临床研究进展与挑战。Prog Pharm Sci Mar. 2021 Vol. 45 No. 3
【6】抗体药物偶联物:肿瘤治疗领域的“魔术子弹”。Prog Pharm Sci Mar. 2021 Vol. 45 No. 3
注:本文旨在介绍医药健康行业研究进展,不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。
声明:本篇文章系整理所得,旨在传播医药行业相关资讯,不做商用,内容版权归药圈时汇所有,欢迎个人转发分享。其他任何媒体、网站如需转载或引用请联系公众号获得授权,并在醒目位置处注明“转自:药圈时汇”。
文章内容 | 药圈时汇 团队




















评论