炎症性肠病与原发性硬化性胆管炎

患者C,30多岁,患有炎症性肠病已经十多年了,这个疾病影响了他的生活质量,也影响了他的心情。唉,不幸的是,他还患有肝病,这种肝病叫做原发性硬化性胆管炎。他的肠粘膜全结肠受累,炎症比较重,经常发作。他的肝功能持续性的不好,有的时候还会出现黄疸。两个疾病加在一个人身上,这种感受是可想而知的。他是个乐观的人,坚持治疗,坚持随访,也坚持工作,好好生活。真的非常同情这个患者,同时也非常敬佩他。目前,他的病情还比较平稳。
今天我们这里想说说,炎症性肠病和原发性硬化性胆管炎,了解一下这两个病的相关知识。
IBD是一类肠道慢性非特异性炎症性疾病,主要包括UC和CD。呈慢性过程,迁延不愈,临床常表现为慢性腹泻、腹痛、腹胀、粘液血便,甚至乏力、消瘦、中毒性巨结肠和结肠癌变等情况。
原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)是一种可累及胆管树所有节段的慢性、进展性、淤胆性肝脏疾病。
PSC与IBD常合并存在于一个人身上。西方国家人群中60%~80%的PSC患者合并IBD(以UC为主),亚洲国家PSC患者中合并IBD的比例相对较低,日本为34%,新加坡为20%,而IBD 患者中仅约8.1%在病程中合并PSC。
PSC合并IBD的临床表现不同于典型IBD,也不同于单纯的PSC,PSC合并IBD较IBD患者发生结直肠上皮内瘤变和结直肠癌的风险更高。因此,把这两种疾病一起来讲,主要是提醒临床医生要了解两病共存的发病机制和临床特点,治疗时兼顾,合理治疗,才能延缓病情进展,避免加速恶化。
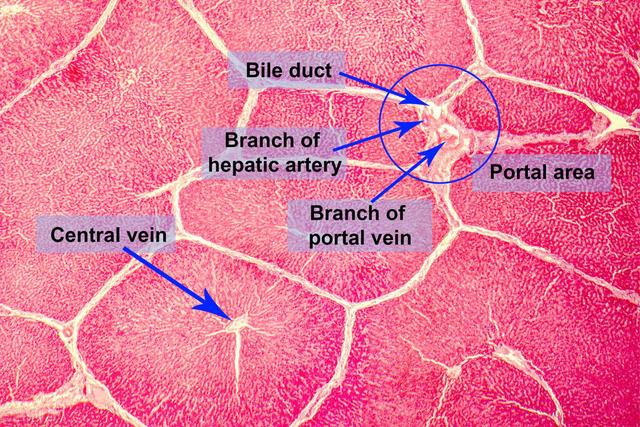
原发性硬化性胆管炎(PSC)到底是一种什么样的疾病呢?我们一起来了解一下它的发病机制、临床表现、诊断及治疗等相关问题。
原发性硬化性胆管炎(PSC)是一种慢性胆汁淤积性肝病,以肝内和/或肝外胆管炎症和纤维化所致的多灶性胆管狭窄为特征。根据目前流行病学数据,PSC发病率为(0.9l~1.3)/10万,小胆管PSC发病率约为0.15/10万,其患病率以北欧国家最高,达16.2/lO万人。
多见于40~50岁男性,诊断年龄为30~40岁。约70%的患者合并炎性肠病(innammatory bowel disease,IBD),以溃疡性结肠炎(ulcerative colitis,UC)为主。PSC发生恶性肿瘤的风险较高,累积胆管癌发生率可达20%,合并IBD者,25年累积结直肠癌发生率高达50%。该病从诊断至死亡或肝移植的生存期为10~22年。目前尚无有效的治疗药物,多数患者最终需要肝移植治疗,但移植后仍存在复发风险。近10年,多个国际学会和团体相继发布了PSC诊疗指南,中华医学会也发布了我国首部PSC诊疗专家共识,这些指南和共识的发布促进了全球PSC的规范化诊疗。但由于疾病发病机制不明,
临床表现多样,难以有效监测,准确诊断和系统管理仍较为棘手,亟待研发有效的治疗药物。
PSC的发病机制和病理生理学
PSC是一种受遗传和环境因素影响的复杂疾病。胆道微生物的免疫耐受被打可能与PSC的发病有关。
PSC的特征是炎症、纤维化和胆汁淤积相互作用。早期主要由自身免疫介导,但重复感染可能是导致疾病进展的重要因素,积极治疗重复感染和扩张显性狭窄是常用的比较有效的治疗方法。晚期PSC患者常发生门静脉高压。
胆道瘢痕形成导致门静脉压迫是出现门静脉高压的主要原因。
PSC进展为恶性肿瘤的风险较高,以胆管癌最多见,亦可见于结肠癌、胆囊癌、胰腺癌,肝细胞癌。
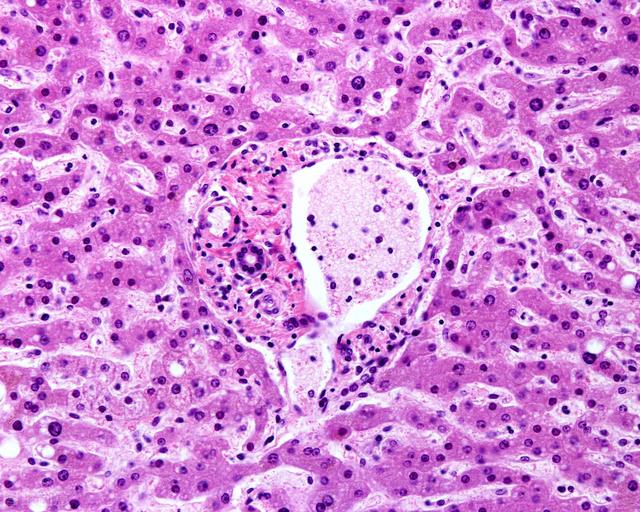
PSC的诊断
临床表现:PSC起病隐匿,临床表现多样,部分患者确诊时无任何临床症状,仅因查体或因患IBD行肝功能筛查时发现胆汁淤积指标或胆管影像学异常而就诊。现有的PSC诊疗指南均建议,对于有胆汁淤积生化表现和典型影像学表现者,在除外其他胆汁淤积病因的情况下,即可诊断。
血液检查:胆汁淤积性肝脏生化异常,碱性磷酸酶(ALP)、Y-谷氨酰转肽酶(transpeptidase,GGT)水平升高。ALP水平升高是诊断的敏感标志物,但无特异性。28%~40%的患者胆红素水平升高,一旦出现黄疸则提示预后不良。转氨酶水平一般正常,如果其水平显著升高,需考虑重叠自身免疫性肝炎(autoimmune hepatitis,AIH)可能。
PSC缺乏具有诊断价值的自身抗体,尽管26%~94%的患者抗中性粒细胞胞质抗体(antineutrophil cytoplasmic antibody,ANCA)阳性,但缺乏特异性,也与预后无关。抗核抗体(antinuclear-antibody,ANA)和平滑肌抗体(smooth muscle anti-body,SMA)阳性和/或免疫球蛋白(亚型)水平升高时,需注意排除AIH和免疫球蛋白G4(IgG4)相关疾病,同时也要警惕重叠综合征可能。PSC患者血清IgG4水平升高(IgG4+PSC)是否与疾病进程相关仍未确定。
影像学检查:胆管影像学检查在PSC诊断和鉴别诊断中具有重要地位。磁共振胰胆管造影(MRCP)作为诊断PSC的首选影像学检查方法。PSC的典型影像学表现为肝外和/或肝内胆管局限或弥漫性狭窄,呈串珠状、枯树枝样改变或假憩室样扩张。MRCP诊断PSC的敏感性为86%,特异性为94%。内镜逆行胰胆管造影(ERCP)是既往诊断PSC的金标准,但作为一项有创检查,其可导致多种严重并发症,如胰腺炎、细菌性胆管炎、穿孔、出血等,已不作为常规推荐。
尽管MRCP具有较高的诊断准确性和安全性,但其诊断早期PSC的敏感性可能劣于ERCP。欧洲消化内镜学会(ESGE)和欧洲肝病研究协会(
EASL)联合发布的PSC内镜应用指南指出,仅在高质量MRCP检查和肝活组织检查仍不能明确PSC诊断时,才考虑行ERCP,并需对ERCP的获益与风险进行详细评估。
肝活组织检查 PSC的典型病理学改变为胆管周围同心圆性洋葱皮样纤维化,但相对少见。肝活组织检查对于诊断PSC并非必须的。对于胆道影像学未见明显异常,但其他原因不能解释的PSC疑诊者,可行肝活组织检查进一步确诊或除外小胆管型PSC。此外,肝活组织检查有助于评估疾病活动度和分期,还可用于协助判断是否重叠其他疾病。
PSC的治疗
药物治疗目前尚无任何药物被证实能延长PSC患者的非肝移植生存期。熊去氧胆酸(UDCA)是目前研究最广泛的PSC治疗药物,但长期效果尚未明确,存在争议。早期使用低剂量UDCA(10~15 mg/kg)治疗PSC的研究和针对小胆管型PSC的研究均认为:UDCA有助于改善PSC患者的肝脏生化指标,但其在改善组织学进展和预后、减少并发症等方面尚缺乏证据。一项中等剂量UDCA(17~23 mg/kg)治疗PSC的随机安慰剂对照试验发现,尽管接受UDCA者在死亡或肝移植方面有下降趋势(7.2%:10.9%),但在症状和肝脏生化改善、胆管癌发生及死亡或肝移植方面均与安慰剂组无差异。一项纳入了150例接受高剂量UDCA治疗的PSC患者的多中心研究,因UDCA组患者严重不良事件和主要终点事件(死亡、肝移植和静脉曲张)发生率较高而终止。荟萃分析结果认为UDCA对PSC无益处。同时也缺乏UDCA降低PSC患者癌症风险的证据。因此,多部指南均不推荐将UDCA作为初诊PSC患者的常规药物,并提出了高剂量(28~30 mg/kg)可能有害的警示,也不建议使用UDCA预防结直肠癌或胆管癌。由于肝移植在我国的推广尚存在困难,《原发性硬化性胆管炎诊断和治疗专家共识(2015)》建议:可对PSC患者尝试进行UDCA经验性治疗,但不推荐使用高剂量。目前尚无类固醇和其他免疫抑制剂可以改善PSC的证据。因此,各指南均不建议使用激素和免疫抑制剂治疗经典PSC,但对于合并AIH或IgG4相关硬化性胆管炎特征的患者,可以考虑使用。
PSC肠道微生态越来越受到关注,已成为重要的潜在治疗靶点。PSC患者菌群失调涉及上消化道和胆道,甚至粪便菌群、细菌和真菌均有参与。已有小样本研究表明,PSC患者接受粪菌移植是安全的,且菌群的多样性和ALP水平下降相关。
在抗生素治疗方面,使用万古霉素治疗的研究最多,虽有小样本研究表明万古霉素有助于改善PSC患者的肝脏生化指标,但尚不支持无胆管炎的患者使用万古霉素或其他抗生素。成纤维细胞生长因子类似物——NGM282可有效调节胆固醇介导的胆汁酸稳态。近期公布的NGM282治疗PSC的II期临床试验发现,NGM282能显著抑制胆汁酸合成,降低纤维化标志物水平,但对ALP水平无明显影响。
内镜治疗 PSC患者的显性狭窄被定义为胆总管狭窄<1.5 mm,或左右肝管狭窄<1 mm。显性狭窄的发生率为36%~50%,伴有显性狭窄的患者胆管癌风险增加,生存期缩短,内镜治疗能有效改善狭窄状态和患者预后,但确切作用尚不清楚。对有症状患者进行重复内镜干预(通常是内镜扩张±支架置入)已成为共识。多项指南均推荐球囊扩张优先于支架置入。然而,瑞典一项研究认为,胆汁淤积和黄疸波动是PSC的疾病特征,而非狭窄治疗后的结果。
有些狭窄不适合或不需要内镜干预。此类患者行ERCP前,应首先考虑保守、放射或外科(包括肝移植)治疗。若行ERCP,应注意排除胆管癌,并适时行活组织检查。因此,临床实践中需要特别关注:辨别显性狭窄的良/恶性至关重要,但比较困难。
目前的共识是:没有明显黄疸和/或即使存在明显肝外狭窄但未发生胆管炎者,应避免行ERCP,除非怀疑患有胆管癌。
肝移植治疗PSC接受肝移植者的预后较好。
欧洲肝移植登记中心报道显示,200l一2015年接受肝移植的患者1年、5年和10年生存率分别为91%、82%和74%。
PSC患者肝移植术后复发率为10%~40%。主要复发危险因素包括男性、术后出现全结肠和/或活动性结肠炎。尽管多数赞成术后使用三联免疫抑制方案,但目前没有证据表明单一或联合方案可以降低PSC复发风险。复发者治疗难度大,其中约50%需再次行肝移植。
并发症管理PSC患者易发生骨质疏松症、营养不良、脂溶性维生素缺乏、乏力、抑郁、瘙痒等。因此,应注意评估PSC患者的骨质疏松风险,有任何维生素缺乏证据,均应考虑多种维生素替代治疗。
目前尚无治疗PSC乏力和抑郁的药物,应积极寻找引起乏力的其他原因。
胆管癌是PSC最常见的死因,应定期监测。CAl99和癌胚抗原CEA可以提供线索,但因其缺乏敏感性和特异性,不适于筛查或确诊。PSC患者胆囊息肉恶变的可能性较大,即使息肉直径<lcm也可能恶变。2015年美国胃肠病学会(ACG)发布的PSC指南建议PSC患者胆囊息肉>8 mm时应行胆囊切除术。
但对于晚期肝硬化和门静脉高压者,应充分考虑手术切除的潜在风险。合并PSC和IBD的患者结直肠癌发病率较高,肝移植术后的结直肠癌风险也进一步增加(每年发生率为1%,可能与长期使用免疫抑制剂有关)。2019年BSG指南建议合并IBD的PSC患者每年行结肠镜检查和结肠活组织检查,未合并IBD者可每5年检查1次。PSC患者胰腺癌的发病率是普通人群的14倍,肝细胞癌的发病率则非常低。
为什么IBD与PSA常合并存在呢?
PSC合并IBD发病机制
目前PSC 合并IBD 的发病机制尚未完全明确,既往研究中提出了许多假说,包括“肠漏”“淋巴细胞归巢”和“肠源抗原”等发病假说,但均不能完全解释PSC 合并IBD 的发病特点。近年来随着“肠肝对话”研究的深入,目前主要基于肠-肝轴从微生态学、遗传学和免疫学角度试图阐明其发病机制。
1. 肠道微生态:随着研究技术手段的提高,发现PSC患者的肠道菌群与正常人群是不一样的。患者的肠道菌群多样性降低,比例失衡,可能与PSC与IBD合并存在的发病基础。
2. 遗传因素:多种遗传相关研究显示PSC的易感基因与适应性免疫有关。PSC 与IBD 致病基因存在重叠但仍有不同,PSC 的致病基因中仅一半与IBD 相关,提示PSC 合并IBD 可能是一种区别于IBD 的独特表型。全基因组遗传相关性分析进一步显示在UC 和CD 患者中,PSC 与UC 的遗传学更为相似,提示PSC 合并IBD 可能与UC 有共同的遗传因素。
3. 免疫因素:PSC 患者肝活组织检查示汇管区可见T淋巴细胞、巨噬细胞和中性粒细胞,以T淋巴细胞为主。遗传角度显示PSC 易感基因多与适应性免疫有关,其中与人类白细胞抗原(HLA)具有强相关性。研究发现,PSC 合并IBD 患者肠道与肝脏B细胞克隆型重叠达8.3%,T 细胞克隆型重叠达8.7%,明显高于正常配对肠道和肝脏组织,提示PSC 合并IBD 患者可能基于肠-肝轴存在相似抗原诱导相同克隆来源淋巴细胞发挥作用。另一方面,淋巴细胞归巢异常在PSC 合并IBD 发病中可能起到重要作用。肠道淋巴细胞归巢主要依赖于肠道特异性内皮黏附分子,如黏膜选址素细胞黏附分子(MSdCAM1)和CC家族趋化因子配体(CCL25)等,正常情况下肝脏并不表达此类黏附分子而在炎症状态下表达,引起肠源性整合素a4b7 和CC 家族趋化因子受体(CCR9)阳性效应淋巴细胞异常归巢,从而导致肝和胆管细胞损伤。
IBD与PSA合并存在的临床表现
PSC 是一种进展性疾病,从肝内外胆管炎症、胆管纤维化、肝硬化、肝功能衰竭直至死亡。患者可表现为胆汁淤积相关肝酶指标升高和(或)胆汁淤积症状。磁共振胰胆管造影特征性改变包括胆道系统呈多灶性狭窄、节段性分布、串珠状排列等是确立PSC诊断的主要依据。对于典型PSC 患者,肝脏活组织检查并非诊断必须,主要用于诊断小胆管型PSC。PSC 病理表现包括胆管周围纤维组织增生、呈同心圆性、洋葱皮样纤维化。
PSC 患者多合并UC,两者疾病表现均呈现波动性,但疾病的表现并不平行,可谓“此起彼伏”。
当PSC 合并UC 时,肠道组织学炎症较轻,病变为全结肠受累,以右侧结肠炎为主,包括直肠豁免和倒灌性回肠炎。结肠炎镜下可见慢性、活动性、轻度结肠炎,组织结构紊乱、固有层增厚,可见嗜酸性粒细胞等炎症细胞浸润;偶见隐窝炎,隐窝脓肿不常见,未见重度黏膜糜烂或溃疡。PSC 合并UC 患者易患结直肠肿瘤。PSC 轻度肝脏受累患者,肠道异型增生和结肠肿瘤发生率更高,提示PSC 疾病严重程度与肠道表现并不一致。PSC疾病预后与IBD分型有关,PSC 合并UC 患者较PSC 合并CD 患者、单纯PSC 患者行肝移植或死亡的风险增高。
鉴于此,PSC 合并IBD 肠道表现多为无症状缓解状态,但易患结直肠肿瘤,因此行结肠镜检查对PSC患者十分必要。国内外共识推荐,对于PSC 确诊患者,建议行结肠镜并行活组织检查评估结肠炎情况;经肠镜或组织学诊断为结肠炎的患者,建议每年复查结肠镜;无结肠炎表现者,每3~5年行1次结肠镜检查。
IBD与PSA合并存在的治疗
目前内镜治疗或肝移植可使胆管严重狭窄或肝硬化失代偿期的PSC 患者获益,但是针对PSC 尚缺乏证实有效的治疗药物。国内外共识不推荐UDCA用于PSC 的常规治疗,对于已使用UDCA的患者,大剂量(>28mg.kg/d)UDCA疗效欠佳且可能增加结肠肿瘤发病风险。
免疫抑制剂包括布地奈德、泼尼松龙、硫唑嘌呤、甲氨蝶呤、他克莫司等对PSC疗效并不确定,探索有效的PSC和PSC合并IBD治疗药物仍至关重要。

1. 新型UDCA:24-去甲熊去氧胆酸(nor UDCA)是UDCA的C23同系物。动物实验研究显示nor UDCA 可缓解PSC模型Mdr2-/-小鼠的胆管纤维化。小鼠的胆管纤维化。随机、双盲临床
Ⅱ期研究显示PSC患者服用nor UDCA3个月后药物耐受性良好,患者的ALP 水平明显降低且呈剂量依赖性,部分患者2周内即可出现药物应答,对皮肤瘙痒和IBD 疾病活动度无明显影响,显示出一定的应用前景。但是对于进展期PSC患者能否耐受nor UDCA、长期使用的不良反应、nor UDCA疗效等仍有待于Ⅲ期临床研究验。
2. 抗生素:使用万古霉素后ALP水平降低65.6%,IBD相关症状(腹泻、血便、腹痛、恶心和呕吐)明显改善。对传统治疗无应答的3例PSC合并UC患者经万古霉素小剂量维持治疗15.3~49.2个月,患者UC 症状均达到临床和内镜下缓解,肝酶指标也有所改善。提示万古霉素对PSC 和PSC 合并IBD长期维持显示出较好的疗效,其机制可能与直接影响肠道菌群和(或)间接调节胆汁酸代谢,激活调节性T细胞和调节肠道黏膜免疫有关。
3. 粪菌移植:粪菌移植可增加肠道菌群多样性,重建肠道菌群平衡以维持肠道上皮完整性,抑制炎症,调节胆汁酸代谢等。
4. 生物制剂:维得利珠单抗(Vedolizumab,VDZ)是重组人源化免疫球蛋白G1单克隆抗体,其选择性结合整合素a4b7,特异地抑制α4b7+淋巴细胞与其天然配体MAdCAM1的相互作用,目前被批准用于IBD 的治疗,安全性优于传统TNFa拮抗剂。黏附分子MAdCAM1在肠源性a4b7 +CCT9+效应淋巴细胞迁移至肝脏引起胆管细胞损伤中起到重要作用,推测VDZ 可能对PSC 有较好的疗效。目前研究未发现VDZ 能有效抑制PSC 进展并维持缓解,但对于PSC 合并IBD 患者维持肠道黏膜愈合疗效较好,提示其可能对于缓解PSC 合并IBD 患者肝脏移植后的肠道症状具有一定的临床价值。
PSC是一个比较难缠的疾病,IBD也不是一个好治的疾病,两种疾病共患,真是雪上加霜,使得肝脏、肠道病情的转归更加复杂,难以预测。
疾病的复杂性,人体的复杂性,使得医学总是不能给出一个肯定的答案,总是在摸索中前行。还好, 医疗技术进步了,医学专家们殚精竭虑,为了人类的健康事业,积极探索发病机制,诊疗方法,相信终归是会战胜病魔的。
希望好的有效的治疗新方法出现,让患者C的疾病有药可用,用了能好,那样患者C就真正得救了。

参考文献:
原发性硬化性胆管炎与炎症性肠病的“恩与怨”,中华消化杂志2020年4月第40卷第4期 Chin J Dig,April2020,Vol.40,No.4
原发性硬化性胆管炎诊治进展 《中国医学前沿杂志(电子版)》2020年第12卷第2期






















评论