复旦校友首次将逆锁键用于实践,对T细胞免疫治疗具有重大意义

“该研究解决了困扰了人们二十多年的难题:即如何获得高信号强度和无毒性的 T 细胞受体。审稿人认为这对 T 细胞免疫治疗具有极大意义。作为亲和力成熟的替代方案,该成果在 T 细胞受体治疗领域具有良好的应用前景。而我认为这篇发表在 Science 的论文就是我十三年来生物学专业学习和研究的最大亮点,也期待下一个高峰。”目前在斯坦福大学做博后研究的复旦校友赵祥表示。对于后续职业规划,他说有回国的打算。

图 | 赵祥(来源:赵祥)
近日,其担任一作的新论文发表在 Science。该研究利用逆锁键,对 T 细胞受体的活性加以精准调控,从而用于肿瘤免疫治疗。据悉,这是一种安全的癌症治疗新技术。相关论文题为《通过逆锁键工程调节 T 细胞受体敏感性》(Tuning T cell receptor sensitivity through catch bond engineering)。
图 | 相关论文(来源:Science)
首创激活信号高+抗原 pMHC 染色体的筛选方法
![]()
赵祥表示,其所研究的对象是人体内的一类细胞,称之为 T 细胞。T 细胞是人体内为数不多的几种可以杀死癌细胞的细胞类型。之所以叫做 T 细胞,是因为这些细胞是在胸腺这个器官里发育成熟的,而胸腺的英文单词是 thymus,取其首字母称之为 T 细胞。
T 细胞广泛存在于人体各组织和器官中,尤其多见于血液、脾脏、和淋巴结。其中,人类的每一滴血中大概有一万个 T 细胞。另外,癌变组织中也常常有 T 细胞的进入,这里的部分 T 细胞可以帮助杀死癌细胞。
人体总共大约有四千亿个 T 细胞,但是他们可能互相都不太一样,其中最大的区别在于一种 T 细胞表达的蛋白质叫做 T 细胞受体(T cell receptor, TCR),不同的 T 细胞其 TCR 序列很可能不一样。TCR 相当于是每个 T 细胞的身份证,如果两个 T 细胞的 TCR 不同,就可以近似理解为这两个 T 细胞并不相同。
那么,TCR 在人体内到底有多么的不同?理论来讲,人类基因组可能产生 1018 种不同的 TCR,这大概是人体内所能存在的 T 细胞数量的一百万倍。然而,这么多种不同的 TCR 的基因序列,并不是完整地编码在人类基因组中。人类基因组中和 TCR 相关的基因片段大约只有上百个,这些片段通过一定方式的排列组合产生多样的、完整的 TCR,并且人体还可以通过随机在基因片段之间插入一些序列,来进一步增加 TCR 序列的多样性。
为何 TCR 序列需要如此多的多样性呢?因为 TCR 不仅仅是一张身份证,它还是开启 T 细胞功能的重要开关。此前,人们发现 TCR 是一种蛋白受体,它可以结合另一种蛋白配体叫做短肽-主要组织相容性复合物(peptide-major histocompatibility complex, pMHC)。其中 MHC 的多样性有限,每个人体内仅表达有限几种 MHC,然而在人类群体中 MHC 存在多态性,你和我的 MHC 可能并不一样,这也是导致器官移植排斥的分子机制之一。
MHC 长得像一个托盘,它重要功能之一在于展示托盘里的东西也就是短肽(peptide)。本质上,部分短肽是由 8-11 个氨基酸排列而成的蛋白质短链。由于人体内编码蛋白质的氨基酸有 20 种,所以短肽的序列多样性可谓大而惊人。
一些短肽来源于“破碎的”蛋白质,即体内的垃圾蛋白质、或被杀死的癌细胞、更或者是病原体的蛋白质,所以短肽的序列其实反映了它来源于哪种蛋白质,这些来源可以统称为抗原,而短肽也可被叫做抗原短肽。
抗原短肽和 MHC 组成的复合物 pMHC,恰恰是 TCR 的配体。pMHC 与 TCR 的结合不是随机的,是特异的。想象一下,人体内含有众多不一样的 TCR,以及序列不一样的 pMHC,它们互相之间并不理睬、也并不结合。只有一对 pMHC 和 TCR “看对眼“了,才会在生物化学上表现出互相结合的特征,这也说明 TCR 识别了其特异性的 pMHC。
其生理意义在于,人体利用多样性的 TCR,可以识别同样多样性的 pMHC,而 pMHC 代表着来源广泛的抗原,包括癌细胞和病原体。因此,TCR 和 pMHC 的结合过程,是人体识别多样性抗原的分子基础。
在理解了 TCR 和 pMHC 相互结合的分子基础和生理重要性后,赵祥想了解的是:接下来 T 细胞会发生什么?一般来说,TCR 结合其特异的抗原 pMHC 后,例如癌症特异的抗原 pMHC,便激活 T 细胞,产生下游信号,一些 T 细胞可以变身为“杀手”,通过特定的杀伤机制杀死癌细胞。
基于上述原理,人们进一步发现 TCR 是“可移植”的,即可以把一些已知的、能够高效识别癌症抗原 pMHC 的 TCR 基因,转移到自身无法产生类似 TCR 的病人的 T 细胞上。这样,癌症患者的 T 细胞就被重新武装起来,因为这时已经获得了外源的高效识别癌症抗原 pMHC 的 TCR,从而可以有效杀死癌细胞。这一治疗方式又被称为细胞治疗,是当下发展迅速的新型肿瘤免疫治疗方法。
所以,现在问题变成了如何获得高效识别抗原 pMHC 的 TCR?这里的“高效”,仅仅指 TCR 在识别 pMHC 后,所产生的 TCR 下游信号强度。一般信号强度越高,T 细胞杀死癌细胞的能力越强。回顾以往,关于什么样的生物化学参数决定了 TCR 的高效程度,相关研究已经进了了二十多年,各种理论众说纷纭,尚没有共识。
这其中影响力最大的,便是亲和力学说,即 TCR 结合 pMHC 的亲和力高低。亲和力数值在化学上为平衡解离常数,等于化学平衡中解离速率除以缔合速率,实验室中可以运用表面等离子共振仪器进行测量。
亲和力学说认为:结合的亲和力越高,TCR 信号强度越高。虽然有很多反例证明亲和力学说并不始终正确,但在过去二十多年的研究和临床试验中,人们多数时候还是通过鉴定高亲和力的 TCR 来寻找高信号强度的 TCR。
但在对癌症抗原 pMHC 特异的 TCR 鉴定中,人们发现的第一个困难是,人体内往往很难分离出高亲和力的识别癌症抗原 pMHC 的 TCR。这个困难其实来源于人体免疫系统对于人体组织的一种保护机制。为了防止 TCR 识别自身的 pMHC 从而导致 T 细胞攻击自身组织和器官,绝大部分能够高效识别自身 pMHC 的 T 细胞在发育阶段就在胸腺被清除了。
然而,很多癌细胞在 pMHC 组成上和健康细胞并没有很大区别,这导致人体内很少存在高亲和力结合癌症特异 pMHC 的 TCR。因此,在 TCR 的工程化改造上,人们首先想到的是通过提高 TCR 结合 pMHC 的亲和力来增强 TCR 的信号强度,这种方法称之为亲和力成熟。
截止目前,绝大多数 TCR 工程化改造的实践都是基于亲和力成熟,一般通过在噬菌体、或者酵母表面表达和展示含有数以亿万计的不同 TCR 突变体组成的 TCR 文库,来不断富集和筛选高亲和力结合 pMHC 的突变体,最终留下的 TCR 突变体的亲和力可能比野生型的 TCR 提高了数百到数百万倍。
然而,接下来更可怕的“噩梦”来了。虽然亲和力成熟的 TCR 在临床试验中也取得了一些成功,例如识别 NYESO-1 抗原的亲和力成熟的 TCR c259。但在另一项临床试验中,亲和力成熟的 TCR A3A 在被用于黑色素瘤病人的治疗中,安装有 A3A TCR 的病人 T 细胞不仅识别癌症抗原 MAGE-A3,也脱靶识别了心脏的抗原 TITIN,这曾导致两例病人死亡,人们将其称之为脱靶毒性。这一案例发生在 2013 年,然而近十年过去了,在新方法问世之前,人们不得不继续使用亲和力成熟的方法,只是得更加小心脱靶毒性。
当赵祥来到斯坦福医学院分子与细胞生理学和结构生物学系 K·克里斯多福·加西亚(K. Christopher Garcia)教授的实验室后,该课题组刚刚发表了一篇论文,进一步明确了 TCR 激活的另一个重要的机制:逆锁键的形成。
逆锁键是一种蛋白质之间的相互作用,可以形象地理解为:当你用拉力想把两个蛋白质分子拉开时,却发现两个蛋白质结合的时间反而延长。因此,只有持续加大拉力到一定程度,这两个蛋白质分子之间的相互作用时间才会减短。这一反直觉的分子间相互作用,曾在多种蛋白质相互作用中被发现,也具有一定的生理意义。
例如:尿液的冲刷反而使大肠杆菌黏附在尿道得更牢,进而导致尿路感染;感染中血流加速导致白细胞黏附在血管壁上更牢,使白细胞更容易穿过血管壁到达感染部位。同样的,TCR 的激活也需要和 pMHC 形成逆锁键。
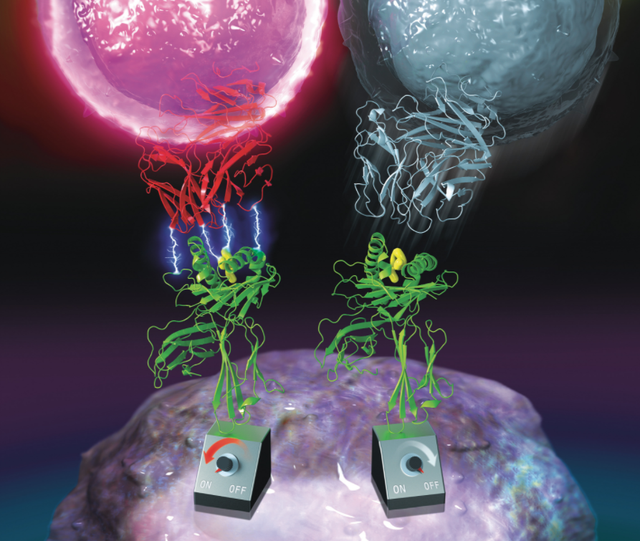
研究中,K·克里斯多福·加西亚教授发现有一种 TCR (TCR55),能以较高的亲和力结合特异的 pMHC,但却因为无法形成逆锁键,导致 TCR55 无法被激活。这个特例说明 TCR 的激活,并不是由亲和力直接决定,逆锁键的形成才是关键。
他还发现另一种 TCR589,能以相同水平的亲和力结合同样的 pMHC,因为可以形成逆锁键,所以 TCR589 可以被正常激活。这给其带来的启发是:或许可以通过仅改变逆锁键的形成、不改变亲和力,以便尽可能地增强 TCR 的激活强度。
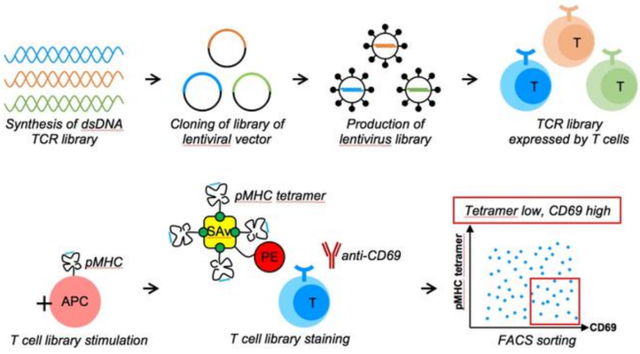
赵祥说:“我们几乎是从头开始设计如何在 T 细胞上表达和展示 TCR 文库,并且首创了激活信号高+抗原 pMHC 染色体的筛选方法,从而筛选到 TCR 信号强度高并且结合了抗原 pMHC 亲和力低的 TCR 突变体。”
(来源:Science)
他和同事发现,符合这一特征的 TCR 突变体无一例外都形成了更强的逆锁键,并且更难能可贵的是亲和力保持在较低水平。为此,他把这一逆锁键工程改造的方法用于上述提到的黑色素瘤相关的 TCR,绕开了亲和力成熟的方法,获得了十几种不同的 TCR 突变体。这些 TCR 突变体不仅可以高效杀伤肿瘤细胞,同时也失去了攻击心脏的脱靶毒性。
总的来说,这一令人兴奋的发现,不仅进一步完善了 TCR 激活的分子机理的研究,确认了逆锁键的重要性,并且首次将逆锁键富集应用于 TCR 的工程化改造中,确立了 TCR 逆锁键工程的操作方法,还在体外实验中获得令人信服的可以高效杀伤肿瘤细胞的、安全无脱靶毒性的 TCR 工程化突变体。
审稿人认为利用逆锁键工程替代传统的亲和力成熟是新颖而有趣的想法,该团队为一个重要问题引入了令人信服的解决方案。特别是对黑色素瘤相关的 TCR 工程改造,是一个强有力的原理验证示例,表明这种受生物物理学启发的方法可以真正地减少脱靶毒性。另一位审稿人补充道这是一项涵盖内容相当广泛的研究,包括从单分子研究,细胞激活到下游信号通路的解析,充分支持了逆锁键和生物力对于 TCR 激活至关重要的假说。
(来源:Science)
有望获得高效和低毒性的 T 细胞受体
![]()
该工作从 2018 年 4 月开始立项。在 2018 年 10 月第一次在 T 细胞表面成功展示了 TCR 文库,并验证了文库的可激活性。2019 年 6 月该团队获得了第一个可以被激活的、逆锁键富集的 TCR55 的突变体,基本验证了关于逆锁键工程的概念。赵祥表示:“那是令人难忘的一天。”
2019 年 9 月,他开始黑色素瘤特异性的 TCR 的逆锁键工程改造,中间因为新冠疫情耽误了四个月的进展。2020 年 10 月,该小组获得多达 13 种不同的黑色素瘤特异的 TCR 突变体,并在此后进一步验证了这些 TCR 突变体杀伤肿瘤的能力、低亲和力以及无脱靶性。
在第一个逆锁键工程改造实验中,因为担心会错过一些已经被成功改造的 TCR 突变体,赵祥采用了不同体系和方法,做了很多备选实验,同时进行了很多 TCR 文库的筛选。那段时间非常辛苦,他长时间用着实验室的流式荧光分选仪,仪器还经常罢工或耗损,被同事吐槽为“sorter breaker”。但最后结果是好的,没想到他在第一个文库中就找到了成功的突变体。
新冠疫情期间,实验进展大幅受影响,2020 年 6 月复工后,他迫不及待地开始黑色素瘤特异 TCR 的筛选,但是因为实验室需要优先开展更为紧急的实验,为此还被实验室管理员质疑这项研究是否为 critical experiments。“顶着巨大的压力,我想这项研究是否 critical,现在已经无需多言了。”他回忆称。直到 2021 年 4 月,所有实验数据基本已经收齐,这时他开始撰写论文,最终刊发于 Science。
该成果的应用前景具体如下:在现在的 T 细胞免疫治疗中,很大一部分是关于嵌合抗原受体(CAR-T),另一部分是 TCR-T 细胞治疗即将高效 TCR 转入病人 T 细胞中。已经批准的 TCR-T 临床试验多达数百项。2022 年 1 月 26 日,第一项 TCR-T 细胞治疗产品被美国食品药品监督管理局(FDA,Food and Drug Administration) 批准,来自英国公司 Immunocore,产品名为 KIMMTRAK,可用于治疗葡萄膜黑色素瘤。

图 | 赵祥(来源:赵祥)
赵祥认为,应逐步淘汰亲和力成熟的方法,将逆锁键工程应用于 TCR 的工程化改造中,这将使人们更有信心地获得高效和低毒性的 TCR,这不仅有利于临床试验的发展、肿瘤的治疗、也是对病人安全的慎重考虑。未来已来,应该及时拥抱新技术新方法。
据介绍,赵祥是安徽合肥人。本科就读于复旦大学生命科学学院,师从郑煜芳教授和胡薇教授,曾经从事过神经发育和寄生虫学的研究。博士就读于新加坡国立大学杨潞龄医学院微生物学系,师从尼古拉斯·加斯科因(Nicholas Gascoigne)教授。
而对于此次研究,他认为局限性在于需要已知的 TCR-pMHC 相互作用的蛋白质晶体结构,而在实际应用中大部分时候人们并没有晶体结构的数据。因此,他打算设计全新一代的 TCR 逆锁键工程改造方法,不依赖于晶体结构,仅根据初始的 TCR 基因序列,便可以开展逆锁键工程改造。
-End-
参考:
1、Zhao, X., Kolawole, E. M., Chan, W., Feng, Y., Yang, X., Gee, M. H., ... & Garcia, K. C. (2022). Tuning T cell receptor sensitivity through catch bond engineering. Science, 376(6589), eabl5282.



















评论