浙大团队研发可溶性微针贴片,结合基因编辑改善耐药性问题
炎症性皮肤病(Inflammatory skin disorders,ISDs)是临床当中最为常见的一种顽疾,这些疾病大多是皮肤上皮屏障对过敏原和病原体产生的炎症反应。
代表性疾病包括银屑病、特应性皮炎(atopic dermatitis,AD),由此引发的全身或局部红斑、多层银白色鳞屑及不同程度的瘙痒,常常反复发作,经久不愈,这不仅极大地影响了美观,还会给患者的生理及心理带来巨大的影响,让人苦不堪言。
然而,当下供患者选择的获批治疗方案寥寥无几。其中,外用糖皮质激素和免疫抑制剂是当前的主流治疗方式,如临床常用的药物地塞米松。但大多数患者在用药后,治疗效果往往难以达到预期,尤其是长期使用极易产生耐药问题。
“我们一直在考虑,如何通过药物制剂的手段来提高糖皮质激素的敏感性,以有效改善糖皮质激素的治疗效果。” 浙江大学药学院教授,博士生导师平渊表示。
近日,平渊团队创新性地提出了通过基因编辑的治疗手段,并结合可溶性微针(microneedle,MN)技术,选择性靶向敲除与耐药相关的 NLRP3 基因,可显著改善银屑病及特应性皮炎的治疗效果。换句话说,NLRP3 基因编辑和糖皮质激素治疗相结合(通过 MN 介导的透皮给药)有望成为治疗 ISDs 的一种潜在有效策略。
该研究成果于 3 月 10 日发表在《科学进展》(Science Advances)杂志上,标题为《微针辅助基因编辑:一种通过 CRISPR-Cas9 靶向 NLRP3 基因的透皮策略用于协同治疗炎症性皮肤疾病》(Microneedle-assisted genome editing: A transdermal strategy of targeting NLRP3 by CRISPR-Cas9 for synergistic therapy of inflammatory skin disorders)。

图 | 相关论文(来源:Science Advances)
可溶性微针制备:胶原三肽、透明质酸为基体材料
以往研究表明,NLRP3 炎症小体(nod-like receptor family, pyrin domain–containing 3)激活后会增加免疫相关细胞的糖皮质激素的耐药性。由于其存在皮肤的表皮及真皮层,这就意味着,目前研发靶向 NLRP3 炎症小体的相关药物很难透过皮肤吸收,抑制其活性,最终治疗效果也时常不尽人意。
为了进行有效给药,平渊及其团队选择了一种更加强效、直接的破局之路 —— 研发了专门用于治疗 ISDs 可溶性微针贴片,可以直接透过皮肤角质层等屏障,在表皮及真皮层降解释放并递送基因编辑药物制剂,从而达到高效治疗的目的。
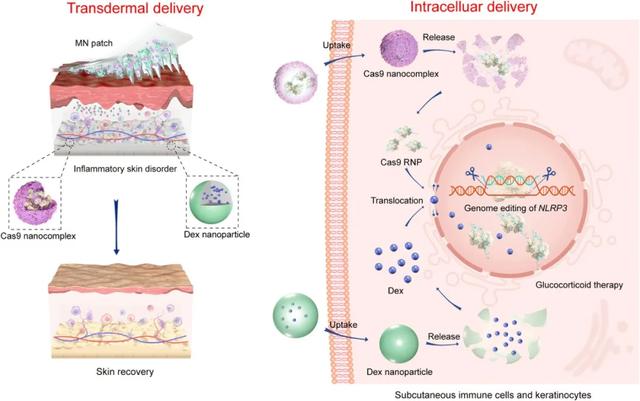
图 | 基因编辑蛋白(Cas9)和糖皮质激素地塞米松(Dex)经皮和细胞内的分级递送示意图(来源:Science Advances)
“这项研究工作从开始到完成一共耗费了约两年的时间,前期的困难主集中于透皮制剂的制备与优化,以及如何修复炎症引起皮肤损伤组织。” 平渊说道。
MN 贴片的设计包含三个组成部分:
(1)聚合物 / Cas9 核糖核蛋白(RNP)纳米复合物,用于 Cas9 的胞内递送,靶向 NLRP3 炎性小体;
(2)地塞米松(Dex)负载的聚合物纳米粒子,用于改善糖皮质激素治疗;
(3)含有 Cas9 纳米复合物和 Dex 纳米颗粒的可溶性 MN 贴片,用于经皮共给药。
具体而言,MN 贴片是通过微模塑的方法从生物相容性的透明质酸(hyaluronic acid,HA)和胶原三肽(collagen tripeptide,CTP)的水溶液中制备的。制备的 MN 阵列贴片的尺寸为 8 mm × 8 mm,15 × 15 的 MN 阵列。扫描电子显微镜(SEM)图像显示,MN 为锥体,基底直径为 200 μm,高度为 600 μm,形貌完整、均匀。
研究发现,CTP 浓度从 0 增加到 10% 时会对 MN 的刚度产生影响。含 10% CTP 制成的 MN 贴片的机械强度为 1.5 N / 针,高于不含 CTP 的 MN 贴片(0.9 N / 针)。
此外,含 10% CTP 的 MN 贴片与含 20% CTP 的 MN 贴片在机械强度上没有显著差异。这样制备出的 MN 贴片具有优异的力学性能,拥有足够的刚度确保皮肤的插入和渗透。然而当 CTP 含量从 10% 增加到 30% 时,MN 表面的粗糙度发生了明显的变化。
因此,平渊团队选择 HA 和 10% CTP 作为基体材料,制备出的 MN 贴片不仅具有良好的生物相容性,还能促进胶原合成,减少经皮水分流失,促进皮肤病变的组织修复。因此,可溶性 MN 贴片可以极大地促进这两种纳米制剂的透皮给药。
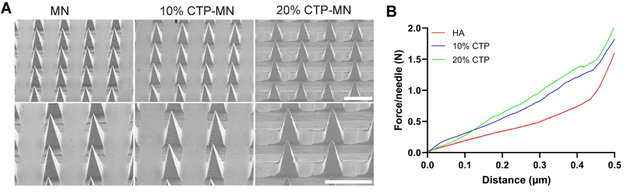
图 | 双载 MN 系统的物理性能(来源:Science Advances)
可溶性微针可持续给药,显著改善炎症表现
为了研究 MN 贴片在体内的降解水平,平渊团队分别评估了罗丹明(rhodamine,一种红色荧光染料)和标记异硫氰酸荧光素(FITC,一种绿色荧光染料)的基因编辑蛋白 Cas9 分别从从聚乳酸 - 羟基乙酸共聚物(poly(lactic-co-glycolic acid),PLGA)及 Cas9 载体中的释放行为。
将 MN 贴片插入到小鼠皮肤后,发现 MN 能迅速吸收皮肤中组织液并迅速溶解,同时能够观察到罗丹明和 Cas9-FITC 在表皮和真皮区域的分布情况。这些结果表明 Dex 和 Cas9 蛋白质纳米制剂在体内的持续性释放,证明 MN 贴片可以作为一个药物储库,在皮肤内能够持续释放治疗药物。
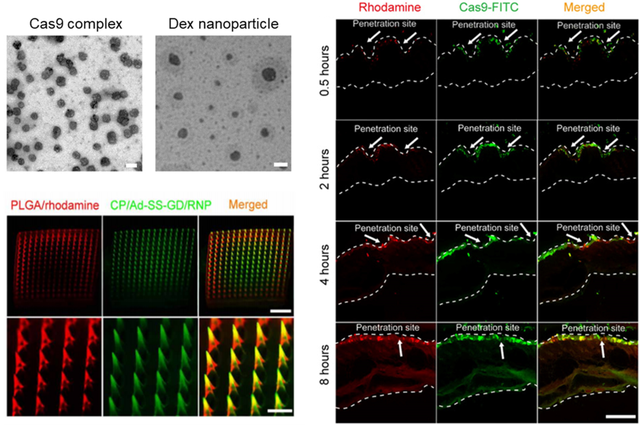
图 | 双载 MN 系统的皮肤穿透及释放情况(来源:Science Advances)
为了评估 MN 贴片对皮肤炎症的治疗作用,他们首先将 2,4 - 二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)涂在裸露的背侧皮肤上,造成典型的病变,如皮肤干燥、严重红斑、出血、瘢痕、水肿、抓痕、糜烂等,从而建立 AD 小鼠模型,然后在局部连续 5 周涂敷 MN 贴片。
实验证明,负载 CP/Ad-SS-GD/ Cas9 或 PLGA/Dex 的 MN 贴片能够适度缓解 AD 症状,其疗效与市面使用的 Dex 乳膏或他克莫司软膏相当。而双载 MN 贴剂(载有 RNP 和 DEX)的抗炎能力最强,小鼠皮肤的水肿、出血、红斑、抓痕和侵蚀明显减轻。
此外,在连续使用 MN 贴片治疗 5 周后,可以观察到小鼠背部的毛发再生。在治疗期间,使用 MN 贴剂治疗的小鼠没有记录到显著的体重减轻,这表明在未来的临床转化中其具有较好的安全性。
瘙痒是 AD 的主要症状,夜间睡眠时,瘙痒会加剧,从而严重影响了生活质量。在 AD 模型小鼠中,后肢抓挠与瘙痒感相关,瘙痒缓解作为 AD 恢复的标志,是判断治疗是否成功的关键指标。与对照组相比,他们发现负载 Cas9 RNP 或 Dex 的 MN 贴片均能显著减轻 AD 小鼠的抓挠行为。
正如预期的那样,由于 NLRP3 基因破坏和糖皮质激素治疗的协同治疗作用,双载 MN 贴剂对瘙痒表现出最强的抑制作用。经过临床评分,发现采用双载 MN 贴片治疗后,小鼠皮炎的严重程度明显降低,这说明 MN 贴片在治疗 AD 时的优异性能。
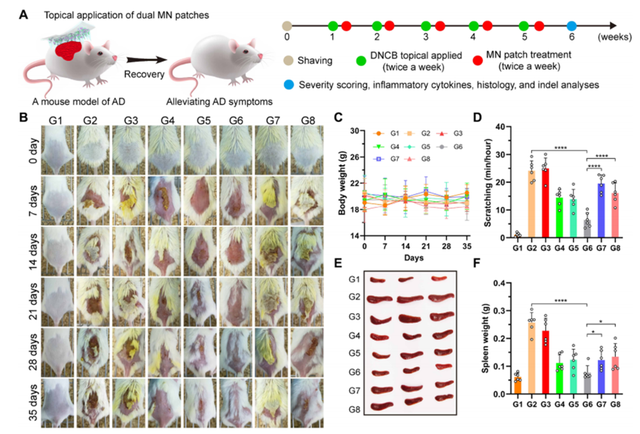
图 | 双载 MN 贴片缓解 DNCB 诱导的 AD 症状(来源:Science Advances)
“目前临床常用的治疗牛皮癣和特应性皮炎的制剂为地塞米松乳膏及他克莫司软膏。与这两款制剂相比,我们的优势在于通过微针技术高效通过皮肤的角质层屏障。此外,可溶性微针含有胶原三肽,可以促进皮肤损伤组织的与胶原合成,促进皮损组织的修复。” 平渊指出。
谈及此次研究的应用场景与产业化趋势,平渊表示,此次研发的微针贴皮未来可应用于感染性皮肤病,如痤疮、皮肤真菌病等;其他病原体感染相关皮肤病以及其他自身炎症性皮肤病,比如自身免疫性表皮下荨麻疹;皮肤因紫外光照射而老化的症状,以及皮肤医美相关的场景。
并强调道,目前已有一些高新科技生物公司在对微针技术转化及产业化进行了大量临床前研究,他们相信这种技术在未来会有广阔的前景和市场。
利用基因编辑手段,突破炎症性皮肤病治疗的核心难题
除了选用可溶性微针直接给药之外,该研究另外一大巧妙之处就在于利用了第三代基因编辑 CRISPR/Cas9 技术,直接精准敲除了 NLRP3 基因,有效降低了 NLRP3 炎症小体的表达。
通过基于 CRISPR-Cas9 的基因编辑对 NLRP3 炎症小体的直接破坏,不仅可在 DNA 水平上抑制了 NLRP3 的激活,而且避免了如小分子抑制剂常见的脱靶效应。
他们最近开发的聚合载体使 Cas9 RNP 能够在细胞内高效递送,确保了 NLRP3 基因在皮下角质形成细胞和免疫细胞中的高效基因组编辑。
同时,NLRP3 炎症小体的破坏可以进一步提高糖皮质激素治疗的敏感性。由于 Dex 在其入核过程中能够诱导核孔扩张,因此它在细胞内的递送将同时有助于基因组编辑剂的核进入。
平渊告诉 DeepTech,其课题组一直致力于基因编辑递送载体的研发及相关疾病的治疗,也一直在探索是否可以利用基因编辑技术来解决炎症性皮肤病的治疗。同时,在浙江大学药学院顾臻教授课题组微针贴片在透皮给药制剂方面的工作,以及华南理工大学王均教授课题组在炎症小体敲除后治疗炎症性疾病的启发之下,他们最终决定尝试利用课题组自己研发的基因编辑递送载体,结合微针给药技术,来治愈炎症性皮肤病。
之所以选择利用基因编辑手段进行医药研究,与平渊个人的研究背景密切相关,更与研究团队成员的集体努力分不开关系。

图 | 可溶性微针双载贴片研究人员:左一平渊,中间万涛,右一潘齐(来源:受访者)
平渊在新加坡攻读博士期间主要从事基因递送的载体研究,并关注非病毒载体在基因治疗方面的应用。但那时候基因治疗方兴未艾,并未有突破性的技术进展。
直到 2012 年以 CRISPR/Cas9 为基础的基因编辑技术问世,并迅速拓展至基因治疗领域,彼时的他正在新加坡南洋理工大学从事博士后研究,当时曾有意识地关注基因编辑领域的动向。
2015 年被新加坡南洋理工大学聘为资深研究员,主要从事仿生蛋白作为药物递送载体的研究。直到 2017 年 10 月以浙江大学 “百人计划” 引进人才的身份加盟浙江大学,并组建自己的研究小组,自此正式开始主攻基因编辑递送技术及疾病治疗。
而目前,他感兴趣的领域是基因编辑非病毒载体,并在疾病与基因治疗中的应用。由于病毒病毒载体存在安全性和免疫原性的问题,如最近有报道慢病毒载体在治疗地中海贫血患者出现了严重的安全性问题,如急性髓细胞白血病及骨髓增生异常综合症,所以他们将目光转移到非病毒载体的研究,提高非病毒载体的安全性,并兼顾其有效性。
下一阶段,他们希望通过研发出安全的非病毒基因载体,针对一些罕见病,如苯丙酮尿症及酪氨酸血症,展开治疗研究。






















评论